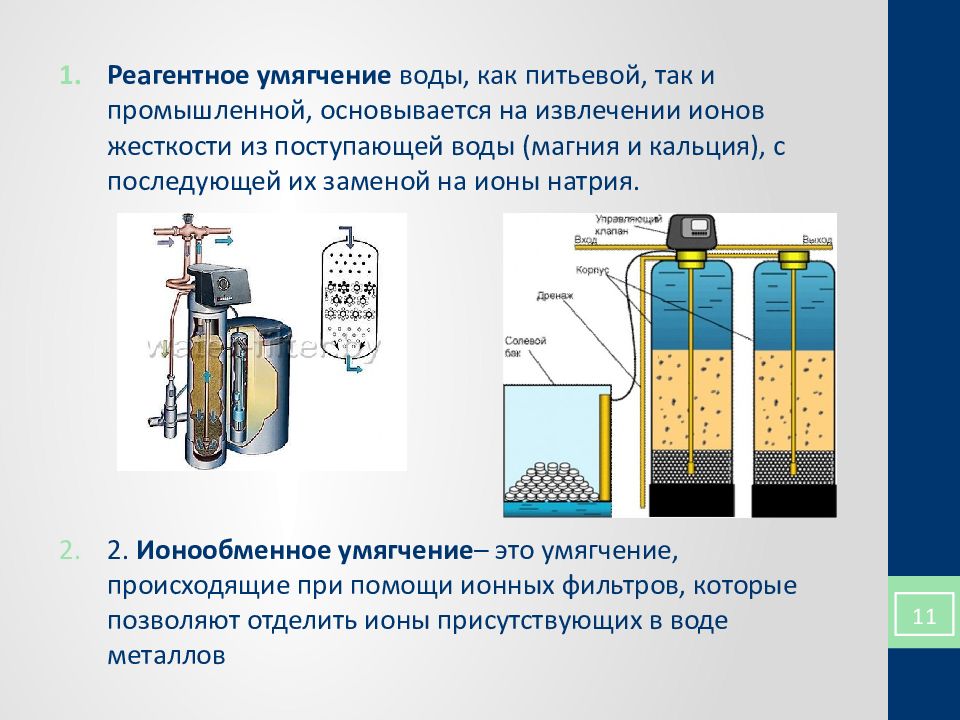
Жесткая вода: причины и следствие
Жесткая вода – природное явление. Дело в том, что грунтовые воды, прежде чем попасть в стакан простого обывателя, проходят осадочные породы известняка, насыщаясь всевозможными солями. По пути к организму человека в жидкость успевают попасть хлориды, фосфаты и другие вредные соединения.
Проблемы наших трубопроводов – жесткая вода
После кипячения только часть из этих веществ выпадают в осадок. Львиная доля грязи и вредностей попадают в организм и оседают на внутренностях техники (чайники, посудомойные и стиральные машины), сокращая срок их эксплуатации. Это не столько неудобно и дорого, ведь ежегодно менять приборы, особенно дорогие, нет желания ни у кого, сколько опасно для здоровья.
Что заставляет многих хозяек искать ответ на вопрос как смягчить воду в домашних условиях? Достаточно простые и яркие в своем проявлении причины, а именно:
- белые разводы на вещах и посуде;
- вымывание цвета одежды и ухудшение структуры ткани, сокращение срока эксплуатации вещей;
- снижение свойств моющих средств – пенящихся;
- накипь на внутренних поверхностях приборов и посуды;
- появление проблем с мочеполовой системой и печенью, связанных с чрезмерным употреблением ионов кальция и магния;
- тусклость и ломкость волос, сухость и дряблость кожи, раздражения кожного покрова.
Это надо знать! Если друзья и знакомые не нахвалят моющее средство или стиральный порошок, который на поверку не отстирывает и не отмывает, это еще не значит, что окружающие заблуждаются в его качественных характеристиках. Возможно, в этом виновата чрезмерно жесткая вода. Ваша! Из вашего крана или колодца!!
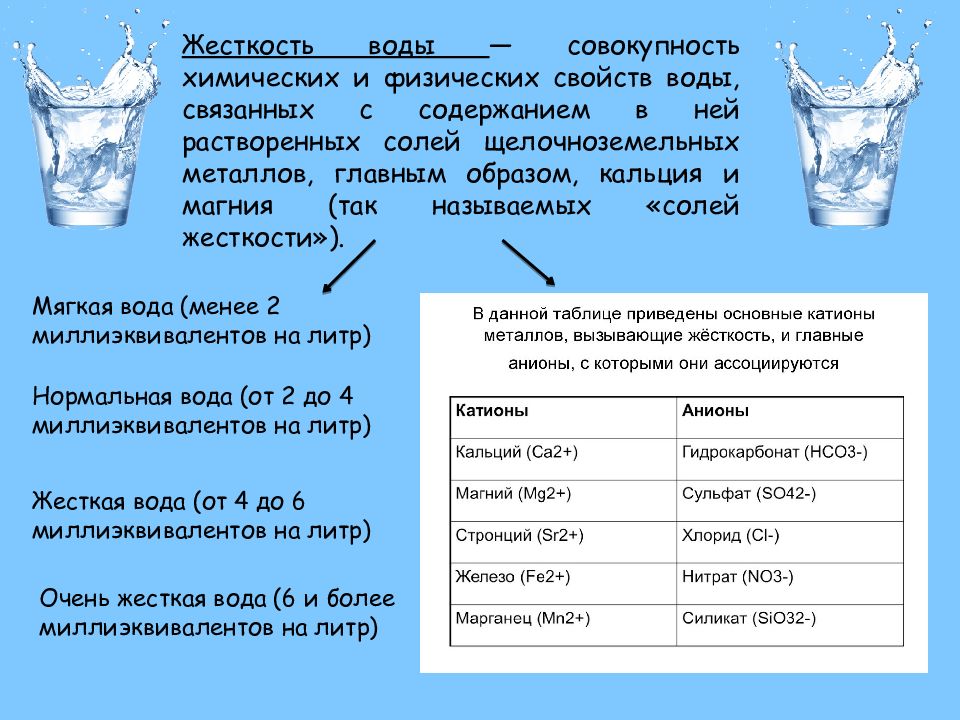
Жесткость воды. Соли жесткости
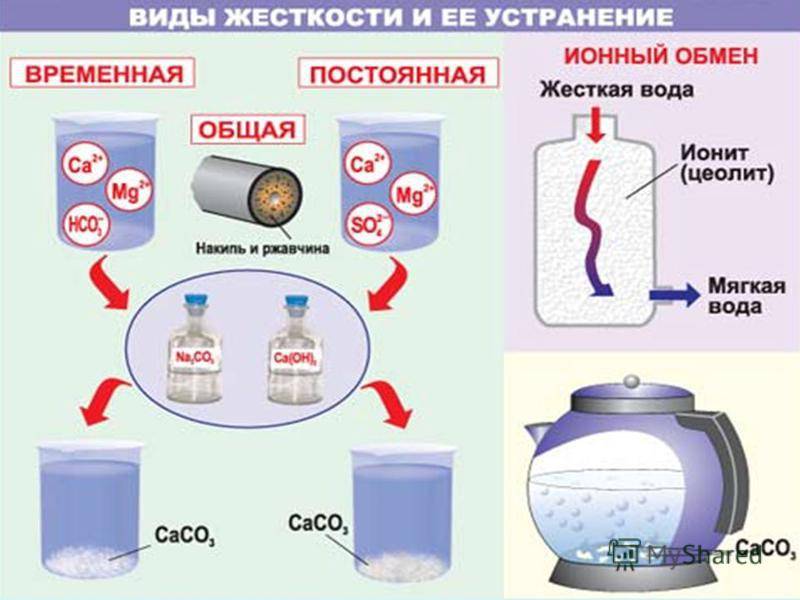
Жесткость воды — это совокупность химических и физических свойств воды, связанных с содержанием в ней растворенных солей щелочноземельных металлов, главным образом, кальция и магния (так называемых «солей жесткости»).
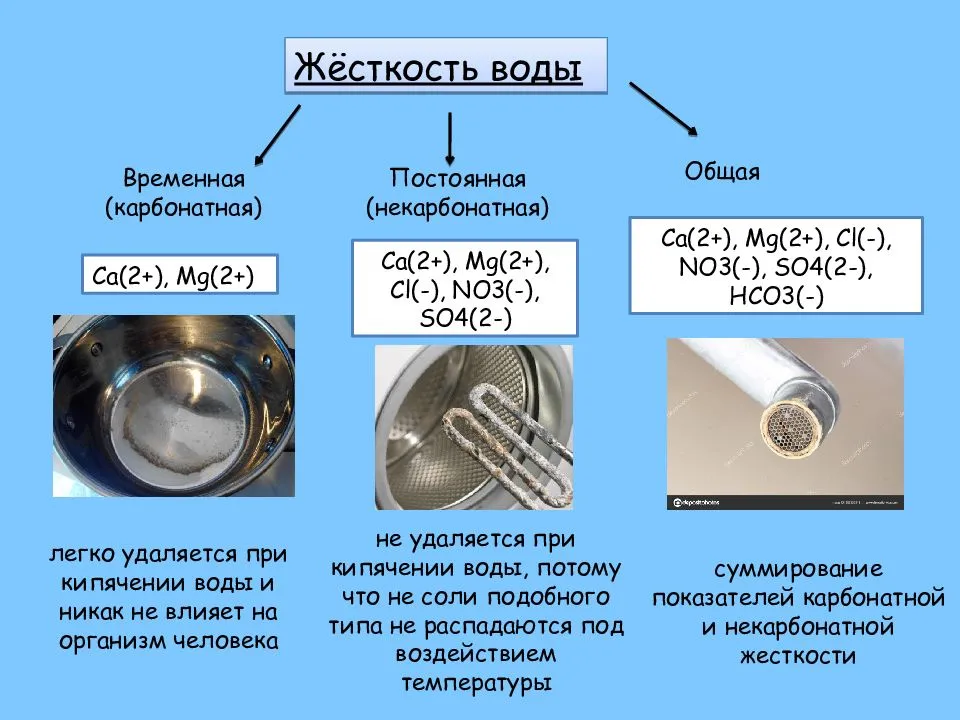
Соли жесткости имеют разные свойства. Так, при нагреве воды, некоторые из них выпадают в осадок в виде накипи, а некоторые — не выпадают. По этому признаку их и начали разделять.
Соли, выпадающие в осадок, стали называть солями временной (или устранимой) жесткости, а соли, которые не выпадают в осадок при нагреве воды, солями постоянной жесткости.
Сульфаты, хлориды и нитраты магния и кальция, растворенные в воде, образуют постоянную (или некарбонатную) жесткость. Они выпадают в осадок исключительно при полном испарении воды.
Временная жесткость характеризуется присутствием в воде наряду с катионами Ca2+, Mg2+ и Fe2+ гидрокарбонатных, или бикарбонатных анионов (HCO3-).
При кипячении воды гидрокарбонаты разлагаются, образуя очень плохо растворимый карбонат кальция, углекислый газ и воду:
Общая жесткость складывается из постоянной и временной.
В данной таблице приведены основные катионы металлов, вызывающие жесткость, и главные анионы, с которыми они ассоциируются.
| Катионы | Анионы |
| Кальций (Ca2+) | Гидрокарбонат (HCO3-) |
| Магний (Mg2+) | Сульфат (SO42-) |
| Стронций (Sr2+) | Хлорид (Cl-) |
| Железо (Fe2+) | Нитрат (NO3-) |
| Марганец (Mn2+) | Силикат (SiO32-) |
На практике стронций, железо и марганец оказывают на жесткость столь небольшое влияние, что ими, как правило, пренебрегают. Алюминий (Al3+) и трехвалентное железо (Fe3+) также влияют на жесткость, но при уровнях рН, встречающихся в природных водах, их растворимость и, соответственно, «вклад» в жесткость ничтожно малы. Аналогично, не учитывается и незначительное влияние бария (Ва2+).
Жёсткость воды — происхождение
Ионы кальция (Ca2+) и магния (Mg2+), а также других щелочноземельных металлов, обуславливающих жесткость, присутствуют во всех минерализованных водах. Их источником являются природные залежи известняков, гипса и доломитов.
Ионы кальция и магния поступают в воду в результате взаимодействия растворенного диоксида углерода с минералами и при других процессах растворения и химического выветривания горных пород.
Источником этих ионов могут служить также микробиологические процессы, протекающие в почвах на площади водосбора, в донных отложениях, а также сточные воды различных предприятий.
Обычно в маломинерализованных водах преобладает (до 70%-80%) жесткость, обусловленная ионами кальция (хотя в отдельных редких случаях магниевая жесткость может достигать 50-60%).
С увеличением степени минерализации воды содержание ионов кальция (Са2+) быстро падает и редко превышает 1 г/л.
В целом, жесткость поверхностных вод, как правило, меньше жесткости вод подземных. Жесткость поверхностных вод подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период половодья, когда обильно разбавляется мягкой дождевой и талой водой. Морская и океанская вода имеют очень высокую жесткость (десятки и сотни мг-экв/дм3).
Жесткость воды — единицы измерения
С 1 января 2014 года в России введен межгосударственный стандарт ГОСТ 31865-2012 «Вода. Единица жесткости». По новому ГОСТу жесткость выражается в градусах жесткости (°Ж).
1 °Ж соответствует концентрации щелочноземельного элемента, численно равной 1/2 его миллимоля на литр (1 °Ж = 1 мг-экв/л). В разных странах использовались (иногда используются до сих пор) различные внесистемные единицы — градусы жёсткости.
За рубежом приняты другие единицы измерения жесткости воды, соотношение этих единиц представлено ниже:
1°Ж = 20,04 мг Ca2+ или 12,15 Mg2+ в 1 дм3 воды;
1°DH = 10 мг CaO в 1 дм3 воды;
1°Clark = 10 мг CaCO3 в 0,7 дм3 воды;
1°F = 10 мг CaCO3 в 1 дм3 воды;
1 ppm = 1 мг CaCO3 в 1 дм3 воды.
Численные значения жесткости измеренные в мг-экв/л, моль/м3, и °Ж, несмотря на различия в обозначении, равны между собой.
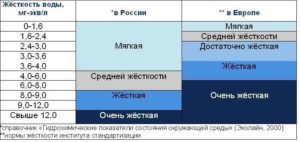
По значению общей жесткости природные воды делят на группы:
- очень мягкая вода (0–1,5 мг-экв/л)
- мягкая вода (1,5–4 мг-экв/л)
- вода средней жесткости (4–8 мг-экв/л)
- жесткая вода (8–12 мг-экв/л)
- очень жесткая вода (более 12 мг-экв/л).
Нормативные требования и рекомендации
Рекомендации всемирной организации здравоохранения (ВОЗ) для питьевой воды:
кальций – 20-80 мг/л; магний – 10-30 мг/л. Для жесткости какой-либо рекомендуемой величины не предлагается.
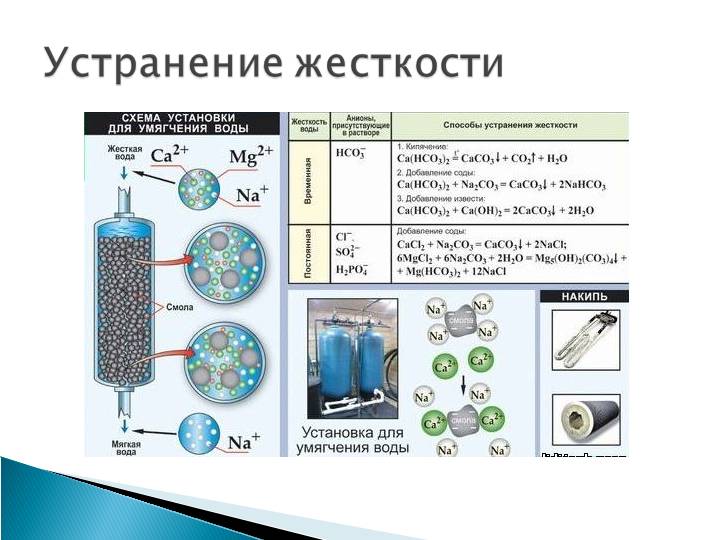
§ 68. Жесткость воды и способы ее устранения
Вода, прежде чем попасть в колодец или водопроводную сеть, просачивается сквозь почву и насыщается в ней растворимыми солями.
Природные воды содержат сульфаты и бикарбонаты кальция и магния, т.е. катионы Са2+ и Мg2+, анионы SO42- и НСО3-. Вода, в которой содержание ионов Са2+ и Mg2+ незначительно, называется мягкой, вода с повышенным содержанием их – жесткой.
При кипячении жесткой воды бикарбонаты разлагаются, образуя нерастворимые карбонаты, например:
Карбонаты осаждаются, и жесткость воды уменьшается. Жесткость, вызываемая содержанием в воде бикарбонатов кальция и магния, называется карбонатной или временной. Жесткость, обусловленная присутствием прочих солей кальция и магния и сохраняющаяся после кипячения воды, называется некарбонатной или постоянной.
Широко известно, что в жесткой воде мыло плохо мылится. Изучим это явление на опыте, взяв в качестве искусственной жесткой воды, например, раствор гипса. Нальем в бюретку разбавленный раствор мыла и будем приливать его понемногу, порция за порцией, к жесткой воде, сильно встряхивая после каждого приливания стакан с жесткой водой. Первые порции мыла будут затрачиваться на образование хлопьевидного осадка, и пены при встряхивании получаться не будет. Только после того, как прекратится образование осадка, появится пена.
Мыла – это натриевые (иногда калиевые) соли органических кислот, и их состав можно условно выразить формулой NaR или KR, где R – кислотный остаток. Анионы R- образуют с катионами кальция и магния нерастворимые соли CaR2 и MgR2. На образование этих нерастворимых солей и расходуется бесполезно мыло. Таким образом, при помощи мыльного раствора мы можем оценить общую жесткость воды, общее содержание в ней ионов кальция и магния.
Для хозяйственно-бытовых нужд требуется вода С незначительной жесткостью. При кипячении жесткой воды образуется накипь. В жесткой воде плохо развариваются мясо, овощи, крупа. При стирке тканей жесткой водой образующиеся нерастворимые соединения осаждаются на поверхности нитей и постепенно разрушают волокна.
При питании паровых котлов жесткой водой образуется накипь. Накипь затрудняет нагревание воды, вызывает увеличение расхода топлива, ускоряет изнашивание стенок котла (рис. 57).
Рис. 57. Разрез трубы водяного отопления. Просвет почти забит накипью
Для понижения жесткости воды применяют различные методы. Перед направлением в паровой котел воду предварительно нагревают, чем устраняют временную жесткость. Для питания котлов высокого давления в настоящее время часто применяют перегнанную (дистиллированную) воду. Для понижения жесткости воды используют химические методы, приводящие к переводу ионов кальция и магния в состав нерастворимых солей, обычно в карбонаты.
Карбонатную жесткость устраняют добавлением известкового молока:
Са(НСО3)2 + Са(ОН)2 = 2СаСO3↓ + 2Н2O
Некарбонатная жесткость устраняется добавкой соды:
CaSO4 + Na2CO3 = CaCO3↓ + Na2SO4
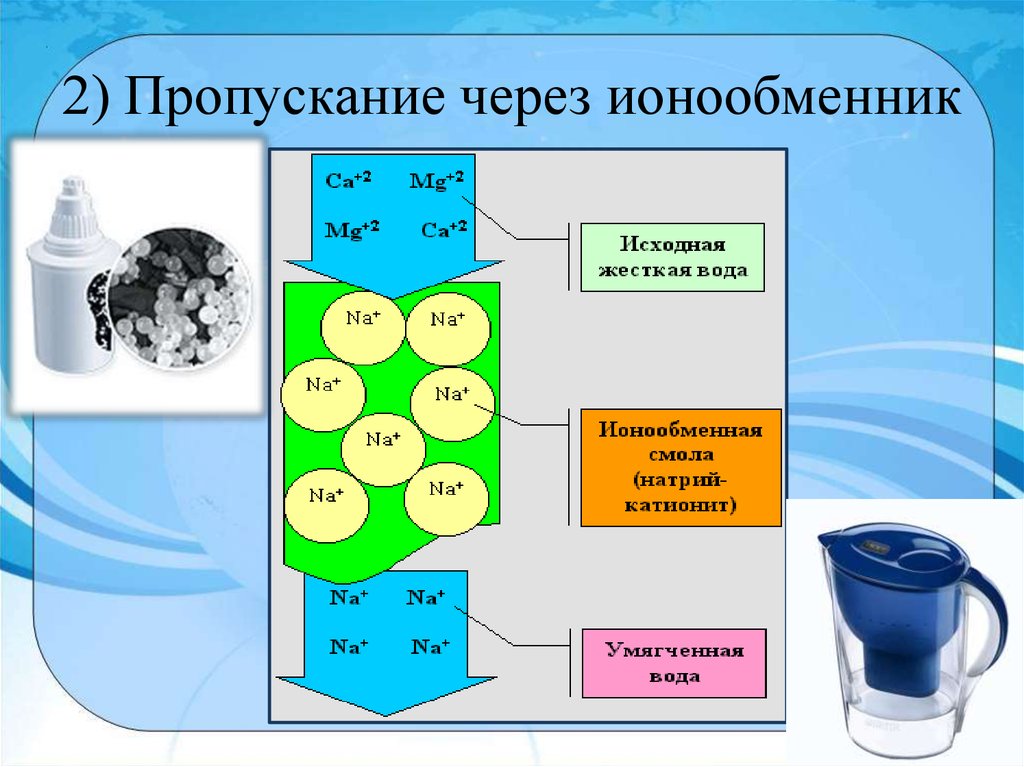
Природную воду, содержащую ионы кальция Са2+ и магния Mg2+, можно смягчить, освободить от этих ионов, заменив их, например, ионами натрия, при помощи ионообмена. Для этого воду на станциях водоочистки пропускают через ионнообменную колонку с катионитом, содержащим подвижные ионы Na+. Ионы кальция и магния удержатся в катионите, а в воду перейдет из катионита эквивалентное количество безвредных ионов натрия:
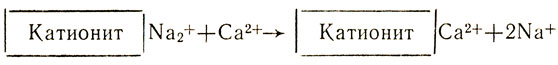
- Какая вода более жесткая: дождевая или речная? Почему?
- Объясните, почему в речной воде содержатся бикарбонаты кальция и магния.
- Как частично смягчить воду, не применяя химических реактивов?
- Напишите в ионной форме уравнения реакций, применяющихся при устранении: а) карбонатной жесткости, б) некарбонатной жесткости.
- Почему постоянную жесткость, обусловленную содержанием в воде гипса, нельзя устранить добавкой гидроокиси кальция?
- Испытайте разными способами на жесткость пробы воды, взятые из разных окрестных источников.
- * Чистую воду получают иногда не путем перегонки природной воды, а пропуская ее последовательно через две колонки, содержащие: одна – катионит, “заряженный” ионами водорода, а другая – анионит, “заряженный” ионами гидроксила. Объясните, каким образом при такой обработке вода освобождается от любых катионов и анионов и становится химически чистой.
Методы умягчения жесткой воды
Проблема жесткой воды понятна, но как же с ней бороться? Для этого необходимо обратиться к услугам тех, для кого вода и ее умягчение являются объектом профессиональной деятельности.
Вакуумная фильтрация воды.
Умягчение воды может проводиться различными методами, их можно разделить на следующие группы:
- Умягчение воды с помощью специальных реагентов. Такая технология требует больших затрат и усилий, к тому же вода после такой очистки имеет неприятный щелочной привкус. Поэтому способ обычно используется только в некоторых отраслях промышленности для предварительной очистки технической воды. Для этого необходимо наличие ряда химических реагентов, емкости и большие затраты на поддержание высокой температуры. В обычном бытовом использовании технология неприменима.
- Ионообменное умягчение воды. Принцип подобной технологии связан с использованием разности концентрации ионов в гранулах особой смолы, благодаря чему ионы солей жесткости впитываются смолами. Подобные гранулы используются как в больших фильтрах, которые можно использовать на входе водной магистрали в дом, так и в специальных кувшинах со сменными картриджами. Это наиболее распространенная в быту технология на сегодняшний день.
- Умягчение с помощью мембраны. В некоторых случаях используются фильтры, основанные на использовании сверхтонких мембран, которые имеют каналы, пропускающие лишь молекулы воды, все остальные взвеси и растворенные вещества оседают на поверхности таких мембран. Каналы настолько узкие, что речь идет о размерах в несколько нанометров. Очистка, разумеется, не стопроцентная, но концентрация тех же солей жесткости после прохождения через мембрану снижается в 50 раз, что делает воду очень чистой. Однако такая технология уступает по многим параметрам ионообменным фильтрам и фильтрам с обратным осмосом.
- Очистка воды по принципу обратного осмоса. Эта методика заключается в использовании принципа, открытого еще много лет назад. Суть его заключается в том, что сквозь полупроницаемую мембрану, разделяющую растворы воды с разной концентрацией ионов солей, вода будет перетекать из более концентрированной в менее концентрированную, но если раствор будет находиться под давлением, то можно принудить воду пойти обратным путем. Этот метод считается одним из лучших по качеству получаемой воды. Ближайший аналог воды, прошедшей через подобный фильтр, это талая вода с ледников.
Вред употребления жесткой воды для людей

Избыток магния и кальция отрицательно сказывается на состоянии:
- волос (в результате их мытья) – замедляется рост, повышается выпадение, развивается перхоть, появляются залысины;
- зубов – они растрескиваются и расшатываются, скалывается эмаль и образуются кариозные зоны;
- костей – они становятся более ломкими и подверженными артриту и артрозу.
Постоянные отложения провоцируют образование камней, нарушающих нормальную работу почек, печени, кишечника. Параллельно снижается и моторика желудка: пищеварение замедляется, больше усваиваемой еды идет в жировые запасы, что способствует быстрому набору веса. Со временем развиваются и сердечно-сосудистые болезни: пребывая в скрытой форме и не проявляя себя, они оборачиваются перикардом, эпикардом, эндокардом или миокардом.
Взаимодействуя с мылом и шампунями, соли выпадают в осадок, забивающий поры. Отсюда – чувство стянутой и сухой кожи после приема душа или умывания. Жировая прослойка постепенно исчезает, кислород не проходит через эпидермис, из-за чего возникают покраснения и другие раздражения, появляется сыпь, прыщи, угри. Приходится восстанавливать микрофлору и, вообще, здоровье с помощью масок, кремов и других средств, часто дорогостоящих, хотя бороться нужно не с последствиями, а с причиной.
Отдельно отметим, что жесткая вода вредна и для животных: содержащиеся в ней излишки солей накапливаются в организмах наших питомцев и приводят к проблемам с пищеварением, понижению иммунитета, недоброкачественному увеличению объема.

Те же собаки или кошки теряют аппетит, вплоть до того, что вообще отказываются от любимого ранее корма, чаще болеют (и очень легко могут простудиться), они набирают массу, но это не мышцы или жир, а скопления жидкости, уже в среднем возрасте у них появляются камни, а значит и проблемы с почками и печенью. У коров снижается удой – с 14-20 до 10-14 литров в сутки, – а также портится настроение, что негативным образом сказывается на вкусовых качествах молока (оно горчит).
Виды жесткости воды
Виды жесткости воды и способы ее устранения приведены в таблице 1.
| Состав жесткой воды | Вид жесткости | Способы устранения | ||
| катионы | анионы | по составу | по способу устранения | |
Ca2+, Mg2+ (в малой степени: Fe2+и Fe3+, Mn2+, Ba2+, Sr2+,Al3+) | HCO3- | карбонатная | временная |
|
| Cl-, SO42-, NO3- | некарбонатная | постоянная | добавление соды | |
| Cl-, SO42-, NO3- (SiO32-) | общая |
|
Таблица 1.
У поверхностного источника по одному и тому же адресу жесткость воды может меняться в зависимости от сезона: например, весной, в период паводка, жесткость воды уменьшается. А летом вода быстро испаряется с поверхностей водоемов, особенно если мало дождей, и жесткость повышается.
В подземных источниках жесткость воды сохраняется примерно на одном, достаточно высоком уровне: 8-10 мг-экв/л.
Большой жесткостью отличается вода морей и океанов, например:
- в Черном море общая жесткость составляет 65,5 мг-экв/л, на ионы кальция приходится 12, магния — 53,5 мг-экв/л;
- в океанах средняя общая жесткость — 130,5 мг-экв/л, на ионы кальция приходится 22,5, магния — 108 мг-экв/л.
В Европе, для сравнения, жесткость не должна превышать 1,2 мг-экв/л. Это значит, что европейцы привыкли пить мягкую воду.
Устранение жесткости
1. Термическая обработка: нагревание воды до 70-80 °С или кипячение позволяет почти полностью устранить временную жесткость. В процессе нагревания гидрокарбонаты распадаются с образованием угольной кислоты:
а карбонат кальция и основный карбонат (или гидроксид при рН>10.3) магния выпадают в виде осадка:
2. Химическая обработка.
а) Карбонатный тип жесткости можно устранить добавлением гашеной извести Ca(OH)2
б) При одновременном добавлении гашеной извести и кальцинированной соды Na2CO3 карбонатная жесткость устраняется известью, а некарбонатная — содой:
Далее идет реакция с известью:
в) Применение полифосфата натрия Na5P3O10 приводит к связыванию ионов Ca2+ и Mg2+ за счет образования хорошо растворимых в воде хелатных комплексных соединений:
3. Ионный обмен осуществляется с помощью ионитов — твердых веществ, имеющих подвижные ионы, которые способны замещаться ионами внешней среды. Причем обмен катионов происходит на катионы, или анионов на анионы.
Например, алюмосиликат Na2O∙Al2O3∙4SiO2∙mH2O имеет пространственную решетку, образованную атомами Al, Si и O. В ней имеются полости, в которых содержатся молекулы воды и ионы Na+. Последние могут замещаться на ионы Ca2+ и Mg2+ при пропускании воды через слой гранул алюмосиликата.
Также применяют ионообменные смолы — катиониты на основе синтетических полимеров. Их состав можно выразить общей формулой Na2R, где Na+ — подвижный катион, а R- — органический радикал с отрицательным зарядом.
При пропускании воды через слои катионита ионы кальция и магния переходят из раствора в катионит, замещая натрий:
Когда процесс ионного обмена доходит до равновесия, катионит перестает выполнять свою работу. Его можно регенерировать погружением в концентрированный раствор NaCl или Na2SO4. При этом ионы Ca2+ и Mg2+ выходят в раствор, а катионит вновь насыщается ионами Na.
Рисунок 1. Принцип действия ионообменных фильтров.
4. Физические методы устранения жесткости основаны на выведении ионов кальция и магния под действием:
- электрического поля — электродиализ;
- магнитного поля;
- магнитно-ионизирующего излучения;
- ультразвуковых волн;
- обратного осмоса;
- электромагнитных волн определенной частоты.
Опасности жесткой воды
Суммируем те опасности, которые несет нам жесткая вода.
Опасность №1: вред здоровью
Фильтр для жесткой воды.
Жесткая вода опасна для здоровья человека. Статистические исследования показывают, что там, где жесткость воды превышает 5-7 мг-экв/л, распространены такие заболевания, как мочекаменная болезнь, артрит, склероз, появляются медицинские проблемы, связанные с нормальной функцией кожи, желудочно-кишечного тракта и т.д. Во всех этих случаях отложения солей кальция и магния поражают кровеносные сосуды, суставы, закупоривают поры кожи, откладываются в виде камней в некоторых органах и т.д.
Поэтому странно звучат различные заявления производителей питьевой воды, которые утверждают, что человеку необходимо употреблять питьевую воду, в которой присутствуют соли кальция. Такая вода, мол, должна нас защитить от рахита и болезней опорно-двигательного аппарата, а соли магния в ней от инфаркта. Ведь та же статистика говорит, что в регионах с традиционно мягкой водой эти заболевания вовсе не превышают обычных показателей. Чтобы организмом усваивался кальций, нужно употреблять молочные продукты, причем доказано, что кальций усваивается хорошо только вместе с жиром, поэтому обезжиренное молоко людям с нехваткой кальция лучше не пить.
Тонкая очистка воды.
Вредность такой воды можно заметить даже без врача. Достаточно помыть руки или искупаться, и вы почувствуете сухость кожи. Она начинает быстро шелушиться, появляется перхоть, покраснения. А чтобы избежать ранних морщин, приходится использовать массу различных кремов и бальзамов. Дело в том, что отложения кальция вступают в связь с естественными выделениями нашей кожи и закупоривают поры, не давая им дышать. Такое купание не приносит облегчения. Возможно, кто-то помнит еще времена, когда люди собирали дождевую воду и умывались ей по утрам. Отмечается ощущение свежести от такой процедуры, ведь дождевая вода практически не содержит в себе примесей и отличается мягкостью. Заменить дождевую воду может талая вода, хотя лечебный эффект ее связан не только с мягкостью, а с особой структурированностью.
Мягкая вода способна кардинально изменить вкус приготавливаемых блюд, даже чай станет намного ароматнее и вкуснее, если предварительно умягчить воду для него.
Опасность №2: бытовые трудности
Очистка воды из артезианской скважины.
Многими хозяйками замечено, что никакие современные средства не могут выстирать вещи так, чтобы они были мягкими и пахли морозной свежестью. Вещи после сушки кажутся неприятными, быстро изнашиваются, часто образуются катышки. Это все тоже результат использования жесткой воды. Можете провести небольшой эксперимент: возьмите только что выстиранную вещь и опустите ее в таз с дождевой водой. Практически мгновенно вы увидите, как она начнет мутнеть. Это частицы стирального порошка и мыла, которые полностью растворить может только мягкая вода.
Еще одна проблема – известковый налет на кафеле ванной, сантехнике и других поверхностях, контактирующих с водой. Порой, чтобы привести такие поверхности в нормальное состояние, необходимо затратить массу сил и специальных химических средств.
Опасность №3: вред для систем отопления
На примере электрического чайника вы можете увидеть, как оседают соли кальция на поверхности нагревательных элементов. Примерно то же самое происходит и в отопительных системах, когда в них используется жесткая вода. А это приводит к тому, что каждый отложенный миллиметр снижает эффективность работы примерно на 10-15%. Таким образом, вы будете терять не только тепло, но и деньги на отопление. Но самое плохое, что может случиться, это выход из строя всей отопительной системы. Отколовшиеся частицы накипи разрушительно воздействуют на прокладки, различные приборы, забивают душевые сетки, форсунки в посудомоечных машинах и т.п. 90% всех поломок водонагревательных приборов связано именно с образовавшейся накипью, которая приносит ежегодно многомиллионные убытки владельцам водонагревательных приборов.
Как определить жесткость
Однако перед тем, как смягчить воду каким-либо средством, нужно сначала убедиться в том, что это необходимо. И настолько ли необходимо? Говорить о том, что снизить жесткость воды стоит, могут такие признаки:
- на постиранной одежде – разводы белого цвета, ткань грубая;
- плохое пенообразование у любых моющих средств;
- белый осадок в воде при отстаивании и после кипячения;
- стянутость, пересыхание кожи после умывания;
- на стенках чайников и кастрюль белая накипь;
- краны, смесители, элементы душа покрыты белым налетом;
- ломкость, излишняя сухость волос.
Однако эти признаки – косвенные, субъективные, сами по себе не дают оснований начинать смягчение воды. Ведь излишне мягкая, она тоже способна навредить.
Убедиться в подозрениях помогут несложные домашние исследования. Для этого существуют специальные тест-полоски, меняющие цвет в зависимости от жесткости воды, либо прибор кондуктометр (в народе – солемер), определяющий электропроводимость воды, которая зависит от количества растворенных в ней солей.
Ну а чтобы совсем уж наверняка убедиться в том, что фильтры и другие методы необходимы, стоит обратиться в лабораторию, изучающую качество воды, ее состав и другие показатели. Там же помогут подобрать правильное оборудование для каждого конкретного случая. Ведь вполне может оказаться, что для воды из скважины в вашем доме присуща не только жесткость, но какие-то другие нежелательные показатели.
Где скачать реферат по физике на тему «Жесткость воды и способы ее умягчения»?
Технологии, рассмотренные кратко, могут не подойти для решения определенной задачи.
Изучить подробно профессиональные способы умягчения воды можно с помощью тематического реферата. Эти материалы можно скачать на специализированном сайте. Некоторые производители публикуют официальные результаты испытаний, заключения независимых экспертиз.
Выводы и рекомендации
Выяснив, на чем основан катионитовый способ умягчения воды, можно сформулировать характерные недостатки. Чтобы разместить крупный комплект оборудования надо выделить площадь 5-6 м кв. В помещение подводят канализацию. Организуют установленный производителем температурный режим. Для качественного подключения и настройки надо привлекать специалистов. Общая стоимость реализации проекта при такой технологии составит 50-80 тыс. руб.
Отдельно следует учесть эксплуатационные затраты:
· для обработки с производительностью 1,5-2 м куб. м/час надо применить 40-50 кг основной загрузки;
· на одну регенерацию расход поваренной соли (воды) составит 6-8 кг (0,5-06 м куб.);
· через 8-10 лет меняют основную загрузку.
Чтобы сохранить эффективность технологии, устанавливают дополнительное оборудование для предварительной очистки. Качественная подготовка может увеличить инвестиционные затраты на 5-30 тыс. руб.
Мощный электромагнитный преобразователь АкваЩит можно купить в фирменном магазине производителя за 17900 руб. с доставкой по РФ. Дополнительные затраты в этом случае не потребуются. Оборудование монтируют самостоятельно за 10-15 минут. Эта модель работает при жесткости на входе до 21 мг-экв/л при потреблении электричества не более 20 Вт/час. Технология не удаляет примеси, поэтому при необходимости применяют дополнительную обработку.
– самое экономичное решение. Простейшие модели в торговых сетях предлагают за 350-450 руб. В отличие от ионообменной или электромагнитной эта технология подходит только для защиты одной локальной рабочей зоны. Отдельные устройства ставят перед стиральной (посудомоечной) машиной, котлом отопления. В процессе эксплуатации надо контролировать и своевременно пополнять загрузку. Способ не подходит для подготовки питьевой воды.
Кипячение и обратный осмос применяют для умягчения 1-10 литров жидкости. Если необходима комплексная защита объекта, применяют электромагнитное преобразование либо ионный обмен.
Норма жесткости воды в аквариуме
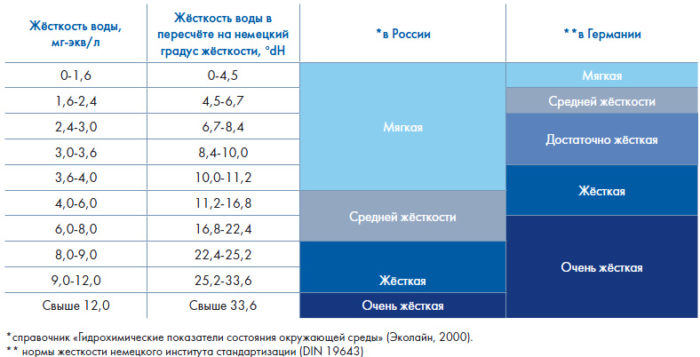
Для измерения жесткости воды используются немецкие градусы, 1 hD соответствует 10 мл окиси кальция в 1 л жидкости. Ниже приведены условные уровни жесткости водной среды:
очень мягкая – 0-4;
мягкая – 5-8 (минералов не хватает);
средней жесткости – 9-16. Оптимальный вариант для сомиков коридорасов, мелких барбусов, харациновых;
жесткая – 17-32. Оптимальный вариант для цихлазом, цихлид, папоротника и сагитарий
Еще высокое содержание минералов очень важно ракообразным, поскольку их раковины постепенно разрушаются в мягкой воде. Наконец, в такой воде комфортно жить и размножаться живородящим аквариумным рыбкам;
очень жесткая – свыше 33
Непригодная среда для большинства водных обитателей.
 Перевод единиц жесткости воды
Перевод единиц жесткости воды
Единой нормы не существует. Растения и рыбы имеют разные предпочтения. Хотя можно обозначить критические значения, которые следует исключить при обустройстве аквариуме. Минимально допустимая жесткость – 6, максимально допустимая – 33.
Обратите внимание! Самым оптимальным вариантом будет максимальное приближение уровня жесткости к естественной среде обитания водных обитателей. К примеру:
К примеру:
- неоновые рыбки хорошо чувствуют себя в воде с жесткостью 6;
- для живородящих стоит использовать воду с уровнем 10;
- улиткам нужна очень жесткая вода для обеспечения панцирной крепости.
 Улитки в аквариуме
Улитки в аквариуме
Отстаивание
Этот способ идеален для больших объемов воды, и лучше всех с ним знакомы дачники и садоводы. Суть сводится к тому, чтобы набрать бак или бутыль, прикрыть тентом или марлей, чтобы защитить от мусора и насекомых, и оставить на сутки или дольше. Как и талая, отстоянная вода не теряет кислород и свою структуру. Однако она не подходит для питья — только для полива растений. Самая большая опасность — размножение микроорганизмов. Чтобы этого избежать, положите на дно бутыли (конечно, это не имеет смысла в случае с баком на 400 л) серебряную сережку или колечко.
Отстоянную воду допускается пить, если предварительно вскипятить.

Устройства для смягчения воды
Чтобы в доме всегда была умягченная вода, можно применять разные методы. Например, для этой цели подходят специальные устройства.
Фильтр-кувшин
Состоит из нескольких сосудов объемом 1,5-3 л. Фильтрация жидкости осуществляется благодаря наличию специального картриджа-фильтра. Фильтрующий элемент задерживает соли и вредоносные примеси. Таким кувшином удобно пользоваться на кухне.
Емкость-накопитель сделана из прозрачного полимера. Картриджи необходимо периодически менять. Самые эффективные смягчители для воды выпускают компании “Барьер”, “Гейзер” и “Аквафор”.
Ионообменные смягчители
Эта методика тоже позволяет быстро смягчить водопроводную воду. В таком фильтре находятся особые элементы, заполненные ионами. Когда жидкость попадает внутрь, ее структура меняется. Преимуществом этого средства для смягчения воды в стиральной машинке и другом оборудовании является то, что жесткие солевые отложения не образуют осадок, поэтому не потребуется устанавливать дополнительные приборы.
Реагентным компонентом ионообменных смягчителей выступает специальная смола. Такие системы требуют регулярного ухода и очистки. Если фильтром пользоваться правильно, он сможет прослужить до 3 лет.

Магнитные и электромагнитные смягчители
Такие приспособления монтируются на трубы и имеют вид накладки. Под влиянием магнитного или электрического пола отложения солей перестают сцепляться с поверхностями и выводятся в отстойник.
Мембранный фильтр
Система обладает большой стоимостью. Ее конструкция включает в себя фильтры и другие устройства. С их помощью можно превратить жидкость из скважины практически в дистиллированную. Однако вместе с этим из воды вымываются и полезные соединения, поэтому такую воду предпочтительнее применять для хозяйственных нужд.
Жесткость воды что это такое — практические советы по нормализации

Жесткость – это свойство воды, которое определяет ее потребительские качества и имеет важное хозяйственное значение. В процессе кипячения жесткая жидкость образует накипь на стенках и внутренних деталях нагревательных приборов, что вызывает ухудшение теплотехнических характеристик бытовой техники
В процессе кипячения жесткая жидкость образует накипь на стенках и внутренних деталях нагревательных приборов, что вызывает ухудшение теплотехнических характеристик бытовой техники.
Не особенно подходит она и для стирки, поскольку способствует снижению очищающих характеристик моющих средств и увеличивает их расход.
| Градусы dH | Характер воды | Жесткость в мг. х экв/л. | Эквивалент в mg/L |
| 23 — 34° | Очень жесткая | выше 12 мг х экв/л | 320 — 530 ppm |
| 13 — 22° | Жесткая | 8 – 12 мг х экв/л | 210 — 320 ppm |
| 9 — 12° | Средней жесткости | 4 – 8 мг х экв/л | 140 — 210 ppm |
| 5 — 8° | Мягкая | 1,5 – 4 мг х экв/л | 70 — 140 ppm |
| 0 — 4° | Очень мягкая | До 1,5 мг х экв/л | 0 — 70 ppm |
Откуда берется высокая жесткость? Ее определяет наличие солей магния и кальция – химических компонентов, выполняющих роль активных регуляторов различных химических процессов в окружающей среде. Естественно, что жидкость, которая берется из разных водоемов, может иметь ту или иную степень жесткости.
При этом река, озеро и любой другой источник пополняются из подземных источников, протекающих в известняковых пластах. Проходя через них, вода обогащается солями жесткости, а значит, будет жесткой. Для сравнения – данный показатель у поверхностных вод всегда заметно ниже, чем у подземных. Жесткость воды в природных источниках постоянно изменяется.
Максимальных отметок она достигает зимой, а минимальных – весной, во время таяния снегов.
Таким образом, жесткой является та вода, которая содержит соли магния и кальция в больших количествах. Кстати, магниевые соли растворяются хуже кальциевых, и жидкость с их высоким содержанием имеет выраженный горький вкус.
Шкала жесткости воды
Выделяются следующие виды жесткости:
- Общая – определяется как суммарная концентрация ионов магния и кальция.
- Карбонатная – зависит от наличия в воде карбонатов, гидрокарбонатов кальция и магния. Практически полностью устраняется в ходе кипячения, поэтому второе название карбонатной жесткости – временная. В процессе нагрева гидрокарбонаты распадаются – образуется угольная кислота, а карбонаты кальция, гидроксиды магния выпадают в виде осадка.
- Некарбонатная – обусловлена присутствием магниевых и кальциевых кислотных солей. При кипячении не устраняется (то есть является постоянной).
Общая жесткость измеряется в GH.
GH показывает суммарное содержание щелочноземельных металлов в виде ионов. Для примера – в воде, значение GH которой близкое к нулю, аквариумные рыбки не живут, употреблять ее в пищевых целях также не рекомендуется.
В мире для измерения показателей жесткости используются разные значения. В России Госстандарт установил следующий показатель – моль на кубический метр.
Числовое значение жесткости, которое выражается в молях на кубический метр, равняется числовому значению жесткости в миллиграмм-эквивалентах на литр.
На западе используют немецкий (d°, dH), французский (f°), американский (ppm CaCO3) градусы.
Влияние жесткости воды, нормативные требования и рекомендации
Какую воду можно употреблять для приготовления пищи и питья? Требования относительно жесткости жидкости зависят от условий конкретной местности. Учтите, что слишком жесткая вода имеет горький вкус и негативно влияет на работу органов пищеварения.
ВОЗ конкретные цифры не называет, хотя исследований на тему связи качества воды с заболеваниями сердца, сосудов и других органов организма проводились неоднократно. Слишком мягкая вода – это тоже плохо, поскольку она нарушает водно-солевой баланс.
Жидкость с жесткостью от 4 мг-экв/ чревата – главная причина образования накипи на внутренних деталях отопительных систем. Вредна она и для кожи, волос.
Жесткость – важный параметр воды, который зависит от количества и типа растворенных в ней минеральных веществ. Смягчение следует делать только после предварительного анализа. Почему? Потому что не все методы смягчения снижают содержание минеральных веществ – они могут просто превращать соли жесткости в соли, которые никак не влияют на рассматриваемый показатель.
















![§ 68. жесткость воды и способы ее устранения [1971 ходаков ю.в., эпштейн д.а., глориозов п.а. - неорганическая химия. учебник для 9 класса]](https://nikastroy.ru/wp-content/uploads/1/9/4/194498883912fa3d5e984c8f0079eddf.webp)