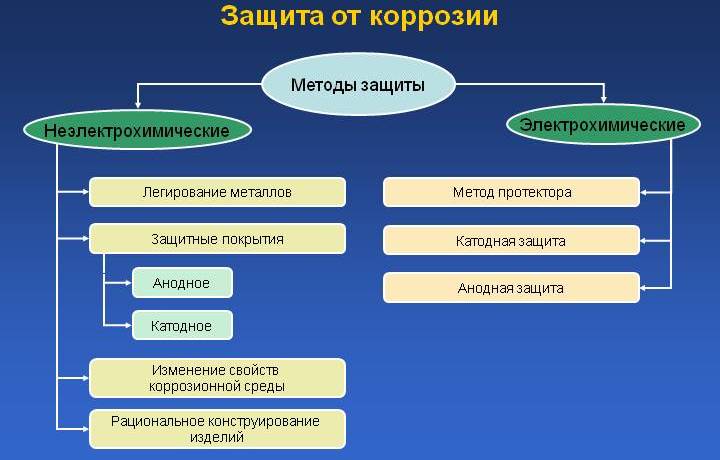
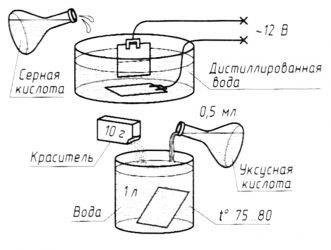
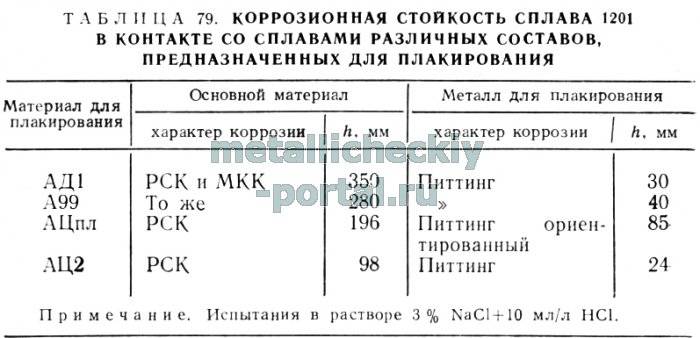
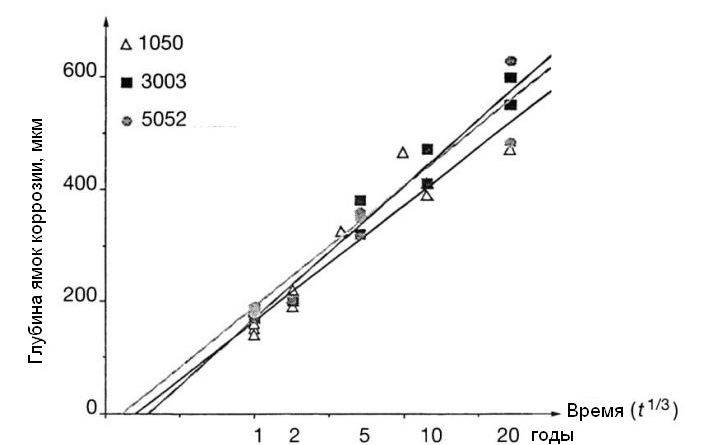
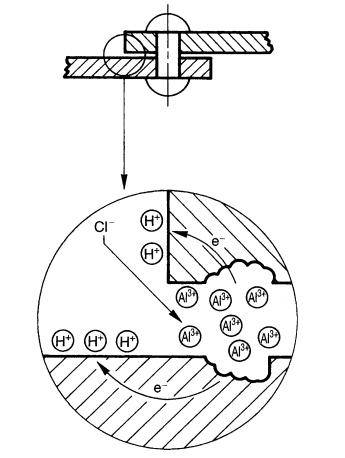
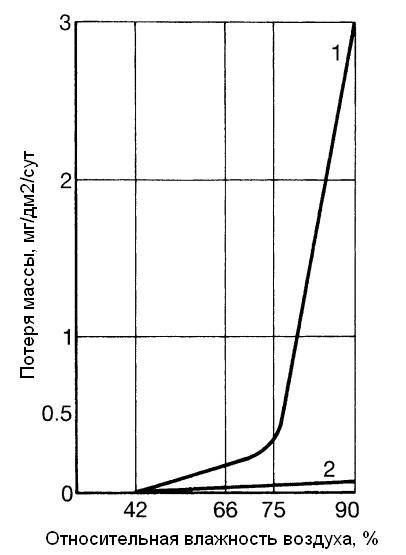
6 Способы обработки коррозионной среды
На производственных предприятиях с коррозией можно с успехом справляться посредством модификации состава агрессивной атмосферы, в которой работают металлические детали и конструкции. Существует два варианта снижения агрессивности среды:
- введение в нее ингибиторов (замедлителей) коррозии;
- удаление из среды тех соединений, которые являются причиной возникновения коррозии.

Ингибиторы, как правило, используются в системах охлаждения, цистернах, ваннах для выполнения травильных операций, различных резервуарах и прочих системах, в коих коррозионная среда имеет примерно постоянный объем. Замедлители подразделяют на:
- органические, неорганические, летучие;
- анодные, катодные, смешанные;
- работающие в щелочной, кислой, нейтральной среде.
Ниже указаны самые известные и часто используемые ингибиторы коррозии, которые отвечают требованиям СНиП для разных производственных объектов:
- бикарбонат кальция;
- бораты и полифосфаты;
- бихроматы и хроматы;
- нитриты;
- органические замедлители (многоосновные спирты, тиолы, амины, аминоспирты, аминокислоты с поликарбоксильными свойствами, летучие составы “ИФХАН-8А”, “ВНХ-Л-20”, “НДА”).
А вот уменьшить агрессивность коррозионной атмосферы можно такими методами:
- вакуумированием;
- нейтрализацией кислот при помощи едкого натра либо извести (гашеной);
- деаэрацией с целью удаления из кислорода.
Особенности очистки алюминия
Если периодически проводить профилактический уход, «трудный» налёт вряд ли образуется. Однако это утомительное занятие, и люди предпочитают делать работу в последний момент. Имеется масса информации о том, как действенно очистить алюминий, и вот два самых простых:
- Механический тип. Пригоден для гладких плоскостей, без рельефного рисунка.
- Химический тип. Разрешён для изделий со сложными шероховатостями на поверхности.
В домашних условиях потребуется фруктовая кислота, гидрокарбонат натрия, и моющее вещество. Также придётся приготовить ватное полотенце, мягкую губку и подходящую тару. В качестве альтернативы можно купить специализированную пасту, однако, она имеет множество вредных элементов, и чистка предметов из алюминия не всегда рекомендуется.
Маленький вес, равномерный нагрев, блестящий внешний облик – параметры, за которые утварь из алюминия цениться многими профессиональными поварами и домохозяйками
Важно отметить, что вещи из этого компонента появились давно, и уже тогда люди понимали правила ухода. Для этого применяли щавелевый и яблочный сок, лук и кефир
Да, химического способа очистить алюминий от грязи тогда не существовало, и вся процедура была очень долгой, но самодельная версия всегда безопаснее и экологически чище.

Бытовая химия для очистки алюминия
Универсальные очистители от окиси – то, чем ещё можно очистить алюминий. Но такой выбор приведёт к потере яркости, ведь в составе присутствует множество химикатов. Для наилучшего эффекта рекомендуется совершать следующее:
- не споласкивать горячую посуду. Высокие температурные перепады пагубно влияют на характеристики практически любой посуды;
- не соскабливать пригоревшую пищу ножом. Такие действия оставят полосы, и очистить алюминий в будущем будет труднее. Также восстановить царапины будет невозможно;
- мыть только руками. Использование посудомоечной машины (из-за больших температур) не допустимо;
- во время обслуживания не наносить сильнодействующие и щелочные препараты, так как без вреда очистить алюминий от окисления не получится. Концентрированные смеси приведут к потемнению металла.
Знание и применение этих особенностей продлит срок эксплуатации кухонных принадлежностей.
Виды коррозии
За всё время работы с металлическими изделиями, люди выделили несколько видов коррозии металла:
- Почвенная — тип коррозии, которая поражает конструкции, находящиеся в земле. Из-за особенного состава грунта, наличия грунтовых вод, происходят химические процессы, вызывающие появление ржавчины.
- Атмосферная — процесс окисления, протекающий в ходе контакта водяных паров воздуха с металлической поверхностью. Чем больше вредных веществ в воздухе, тем быстрее появиться коррозия.
- Жидкостная — такому виду коррозии подвержены металлоконструкции, находящиеся в воде. Если в жидкости содержится соль, процесс разрушения материала будет протекать быстрее.
Выбор антикоррозийного состава зависит от того, в какой среде будет эксплуатироваться металлическая деталь.
Как вода воздействует на описываемый металл?
Коррозия алюминия в воде может наступить от повреждения верхнего слоя и защитной пленки. Высокая температура жидкости способствует скорейшему разрушению металла. Если алюминий поместить в пресную воду, то коррозионные процессы практически не будут наблюдаться. Если повысить температуру воды, то изменений можно не заметить. Когда жидкость нагревается до температуры 80 градусов и выше, то металл начинает портиться.

Скорость коррозии алюминия увеличивается, если в воду попадает щелочь. Описываемый металл обладает повышенной чувствительностью к соли. Именно поэтому морская вода для него губительна. Чтобы использовать этот металл в морской воде, необходимо в жидкость добавлять магний или кремний. Если использовать лист алюминия, в составе которого есть медь, то коррозия сплава будет протекать гораздо быстрее, чем у чистого вещества.
Методы удаления нагара с алюминия
Нагар – распространенное явление для алюминиевой посуды. Удалить остатки пригоревшей пищи и вернуть изделию естественный блеск и чистоту довольно сложно, учитывая мягкость и капризность металла. Однако справиться с проблемой возможно, используя доступные средства и маленькие хитрости.
Читать также: Как проверить кнопку мультиметром
Зубной порошок
Дабы убрать нагар со дна кастрюли, обильно засыпьте его зубным порошком и немного сбрызните водой. Оставьте емкость в таком виде на ночь, а утром удалите загрязнения силиконовой лопаткой или мягкой губкой.
Хозяйственное мыло и уксус
Для очистки нагара воспользуйтесь следующим эффективным методом:
- Подготовьте большую эмалированную кастрюлю, в которой свободно разместится емкость, требующая чистки.
- Влейте в посуду 1,5 л воды, добавьте натертое на терке хозяйственное мыло и 150 мл столового уксуса.
- Закройте емкость крышкой и проварите очищаемое изделие 30 минут.
- Вымойте алюминиевую посуду слабым мыльным раствором, а затем тщательно прополощите.
ПВА и мыло
Способ удаления серьезных загрязнений:
- В кастрюле вскипятите 3 л воды.
- Добавьте 1 ст. л. клея ПВА и треть бруска банного мыла, нарезанного тонкими ломтиками.
- Прокипятите раствор под закрытой крышкой 30-40 минут.
- Вымойте кастрюлю моющим средством и хорошо прополощите проточной водой.
Другие методы борьбы с нагаром
Для удаления незначительных загрязнений воспользуйтесь одним из представленных способов:
- Таблетка для посудомоечной машины. Залейте кастрюлю водой, чтобы жидкость покрыла нагар на 2 см. Добавьте 1 таблетку для посудомойки (Finish) и проварите смесь полчаса. Тщательно вымойте кастрюлю из алюминия и хорошо прополощите.
- Хозяйственное мыло. Для удаления свежего нагара залейте посуду кипятком, добавьте ½ бруска хозяйственного мыла, натертого на терке, прокипятите под закрытой крышкой на слабом огне в течение получаса. Остудите емкость и удалите нагар кухонной губкой или силиконовым скребком.
- Бытовая химия. Справиться с нагаром и другими видами загрязнений помогут специальные средства. При выборе препарата убедитесь, что он подходит для алюминия, внимательно ознакомьтесь с инструкцией и примите рекомендованные меры безопасности.
- Поваренная соль. Дабы отмыть сильный нагар, в посуду влейте 1 л воды и добавьте 2 ст. л. соли. Прокипятите смесь 20 минут, а затем вымойте изделие губкой.
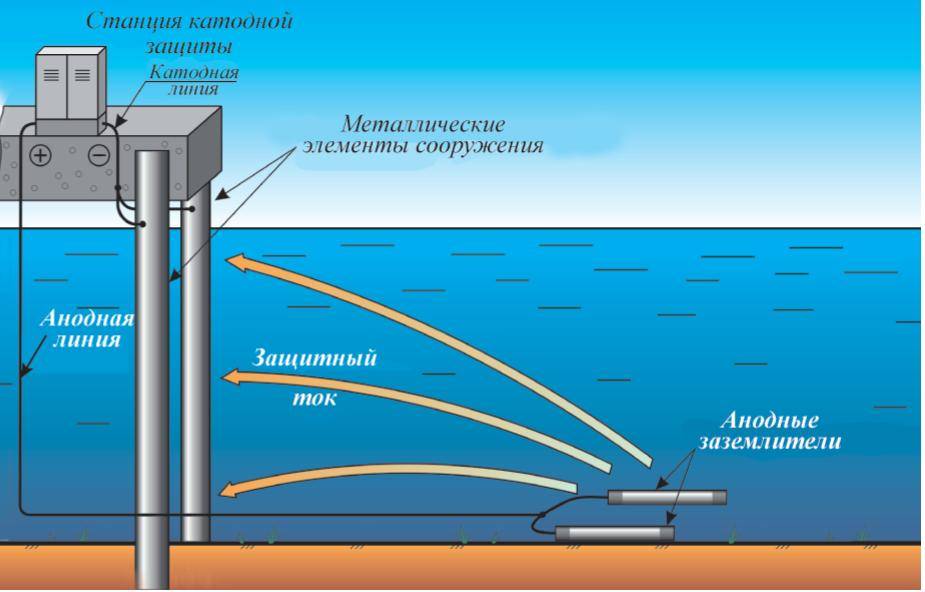
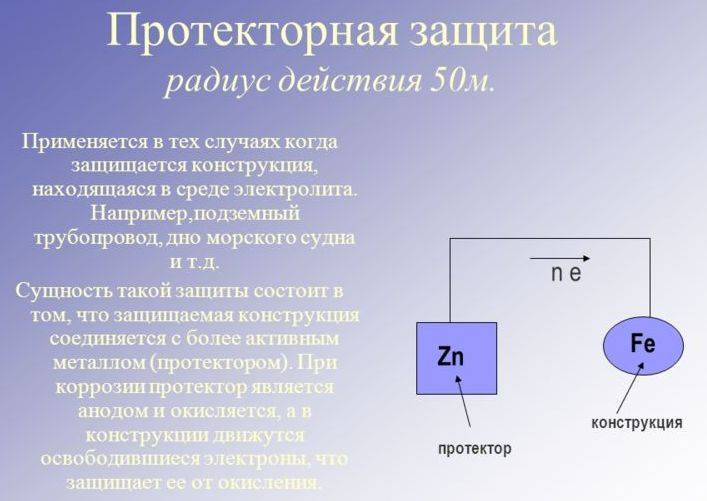
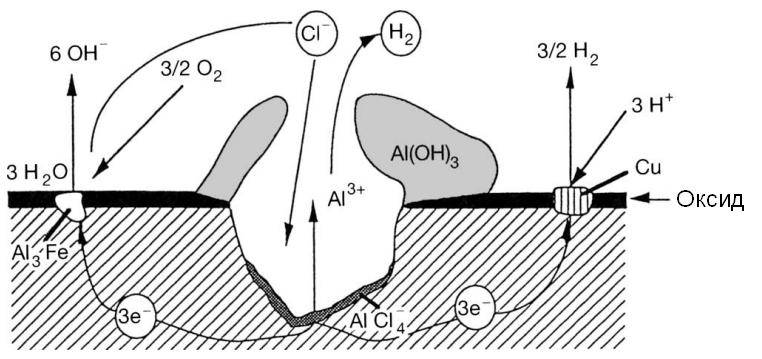
Причины и признаки электрохимической коррозии
Электрохимическая коррозия отличается от химической тем, что процесс разрушения проходит в системе электролитов, отчего внутри этой системы возникает электрический ток. Два сопряжённых процесса, анодный и катодный, приводят к удалению из кристаллической решетки металла неустойчивых атомов. Ионы при анодном переходят в раствор, а электроны от анодного процесса попадают в ловушку к веществу-окислителю и связываются деполяризатором.
Таким образом, деполяризация – это отвод с катодных участков свободных электронов, а деполяризатор – вещество, которое отвечает за этот процесс. Основные реакции происходят с участием водорода и кислорода в роли деполяризаторов.

Существует множество примеров электрохимической коррозии разного типа, которая оказывает воздействие на металлические поверхности в природе и проходит под влиянием различных условий. Водород при этом работает в кислой среде, а кислород – в нейтральной.
Практически все металлы подвергаются электрохимической коррозии, и по этому признаку их разбивают на 4 группы, определяют величину их электродного потенциала:
- активные коррозируют даже в той среде, где нет окислителей;
- среднеактивные вступают в реакцию окисления в кислотной среде;
- малоактивные не вступают в реакцию при отсутствии окислителей и в нейтральных, и в кислых средах;
- не вступают в реакцию — высокой стабильности (благородные металлы, палладий, золото, платина, иридий).

Но эта же реакция может протекать и в воде, в растворах оснований, солей и кислот. В узкоспециальном различии атмосферной коррозии различают почвенную и аэрационную, морскую и биологическую (протекающую под воздействием бактерий).
Есть даже электрическая коррозия, которая протекает под воздействием электрического тока, и является результатом работы блуждающих токов, возникающих там, где электрический ток используется человеком для осуществления определенной деятельности.
Гомогенная металлическая поверхность при этом разрушается из-за термодинамической неустойчивости к окружающей среде. А гетерогенная – из-за состава кристаллической решётки, в которой атомы одного металла держатся плотнее, чем атомы инородных вкраплений. Эти реакции отличаются скоростью протекания ионизации ионов, и восстановления окислительных компонентов окружающей среды.
Разрушение металлических поверхностей при электрохимической коррозии состоит в одновременном протекании двух процессов: анодного и катодного, и отличия процессов состоят в том, что растворение происходит на анодах, которые и контактируют с окружающей средой через множество микроэлектродов, которые входят в состав поверхности любого металла и замкнуты на себя.

Сферы использования металла и его соединений
Значительное количество алюминия находится в фарфоре, кирпиче, цементе. По масштабам использования сплавы металла уступают место железу. Широкое применение алюминиевых материалов в различных отраслях связано с рядом физических и химических параметров:
- невысокая плотность;
- металл не ржавеет, обладает устойчивостью к коррозии;
- имеет высокую электропроводность;
- легко поддается штамповке, прокату и обладает ковкостью;
- пластичен и прочен;
- на поверхности алюминиевых сплавов легко наносятся декоративные и защитные покрытия.
При добавлении разных лигатурных компонентов сплавы на основе алюминия приобретают новые свойства, формируя интерметаллические соединения или твердые растворы.
Не все материалы способны образовывать оксидные пленки даже принудительно. Для сохранения антикоррозионных свойств материала кислотно-щелочной баланс должен соответствовать диапазону от 6 до 8 единиц.
Чистый алюминий практически не подвергается воздействию агрессивной среды. Даже тонкое покрытие поверхности металлом без примесей способно предотвратить реакцию.
Основную массу металла используют для получения легких сплавов:
- дюралюминия, в котором находится 94% алюминия, 4% меди, по 0,5% железа, марганца, кремния и магния;
- силумина — до 90% основа, до 14% кремний и натрий.
Неорганические соединения
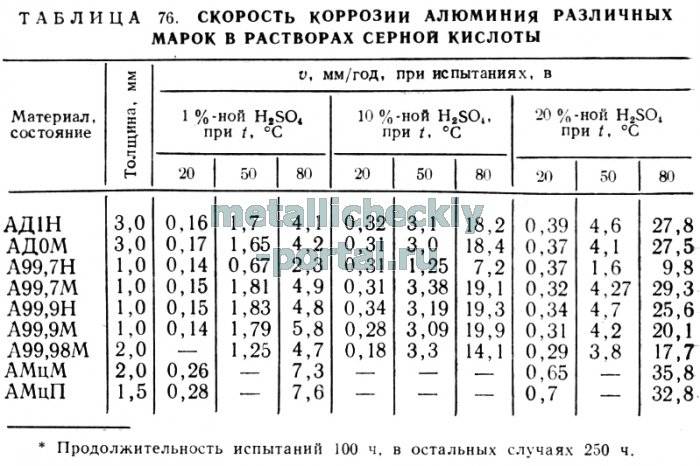
Алюминий не стоек к действию кислот. Исключение составляют концентрированные азотная и серная кислоты — их окислительные свойства настолько сильны, что при контакте с алюминием на его поверхности образуется прочный слой оксида алюминия, препятствующий дальнейшему разрушению металла (поэтому концентрированную азотную или серную кислоту перевозят в алюминиевых цистернах). Разбавленная азотная или серная кислота — более слабый окислитель — энергично реагирует с алюминием.
В кислотах алюминий растворяется тем хуже, чем меньше содержит дополнительных примесей. Следует помнить, что анодное окисление не защищает от воздействия кислот, поскольку они разрушают слой Al2O3. Химическая активность кислот увеличивается с ростом температуры. Например, с возрастанием температуры на 10°С скорость коррозии удваивается. Увеличение концентрации кислоты, как правило, увеличивает скорость коррозии (концентрированные серная и азотная кислоты — исключение).
Соляная кислота вызывает сильную коррозию. Действие этой кислоты нельзя ослабить добавлением ингибиторов.
Фтороводородная кислота оказывает самое сильное влияние на алюминий. Даже непродолжительное взаимодействие разбавленной кислоты ведет к полному растворению алюминия.
Кислородсодержащие кислоты хлора (HClO4, HClO3, HClO) вызывают сильную коррозию алюминия.
Серная кислота вызывает равномерную коррозию алюминия, интенсивность которой зависит от концентрации. Разбавленная кислота средней концентрации при комнатной температуре отличается умеренной агрессивностью. Наиболее агрессивна кислота концентрации 80%. Некоторые вещества, входящие в состав алюминиевых сплавов, а также ионы, содержащиеся в воде (особенно фториды и хлориды), усиливают действие серной кислоты.
Сернистая кислота вызывает локальную коррозию алюминия.
Сера и халькогены (селен и теллур) на алюминий не действуют.
Фосфорная кислота разрушает алюминий умеренно или сильно (в зависимости от концентрации).
Мышьяк при комнатной температуре не действует на алюминий.
Мышьяковая кислота (H3AsO4) и окись мышьяка сильно разрушают алюминий, а мышьяковистая кислота (H3AsO3) без нагревания на него не влияет.
Азотистая кислота (HNO2) при комнатной температуре не действует на алюминий.
Азотная кислота (HNO3) воздействует на алюминий по-разному, в зависимости от концентрации. Разбавленные растворы интенсивно разрушают алюминий. В концентрированных растворах вследствие окислительных процессов поверхность алюминия пассивируется и коррозия замедляется. Наиболее сильную коррозию вызывает кислота концентрацией 10-60%. Действие азотной кислоты приводит к равномерной коррозии. С увеличением чистоты алюминия возрастает его стойкость к коррозии. Наличие в составе слава примесей меди, кремния, магния усиливает воздействие азотной кислоты.
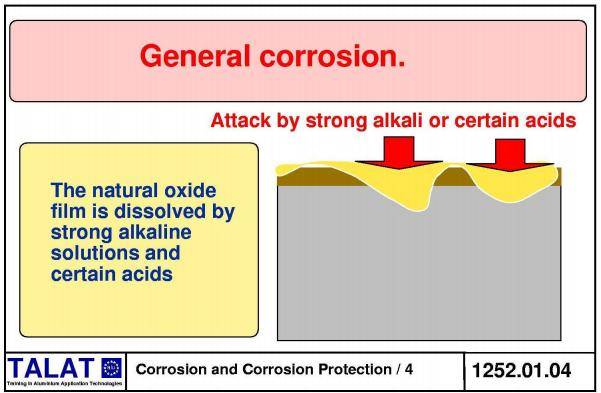
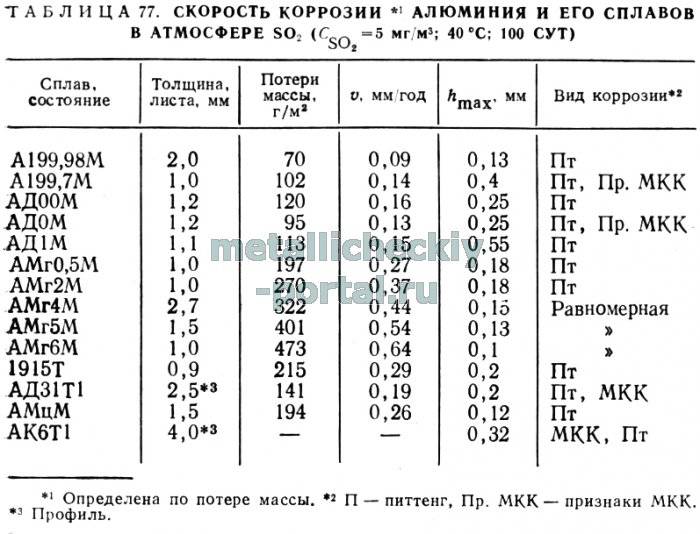
Ржавеет ли аллюминий: причины
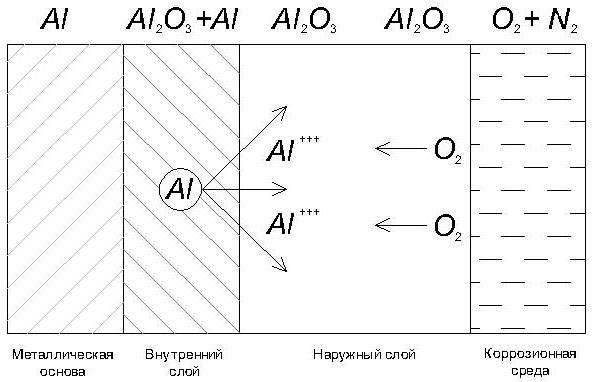
Если сплавы железа ржавеют относительно быстро, то при нормальных условиях алюминий практически не разрушается. На его поверхности появляется защитная пленка из оксида алюминия. Она имеет тонкий слой примерно 5−10 мм, но обладает высокой прочностью. Этот слой не позволяет влаге, воздуху разрушать структуру металла.
Как только нарушается целостность оксидной пленки, металл корродирует. Причинами повреждения защитного слоя может являться взаимодействие с кислотами, растворителями и щелочами, механическое воздействие (например, силы трения).
В промышленных районах и в городской среде оксидная пленка нарушается за счет продуктов распада топлива, взаимодействия с серой и с окислами углерода.
Интенсивно растворяют пассирующий слой такие элементы, как фтор, хлор, натрий, и соединения брома. Строительные растворы с добавлением цемента также приводят к быстрой порче металла. Морская вода также вызывает интенсивное разрушение чистого алюминия, поэтому на практике используют сплав с медью и марганцем, получивший название дюралюминия.
Гальванические пары способны вызывать электрохимическую коррозию. В местах соединений двух разнородных металлов ржавчина выступает наиболее заметно. При этом коррозии подвергается только один металл, а второй выступает в роли источника. Поэтому не рекомендуют использовать алюминиевые кузова при контакте с железом.
Проявление коррозии алюминия
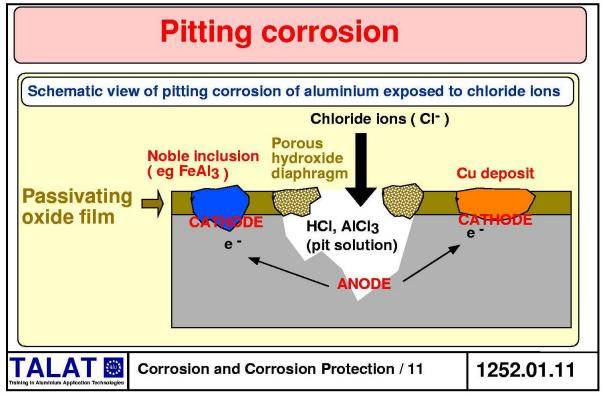
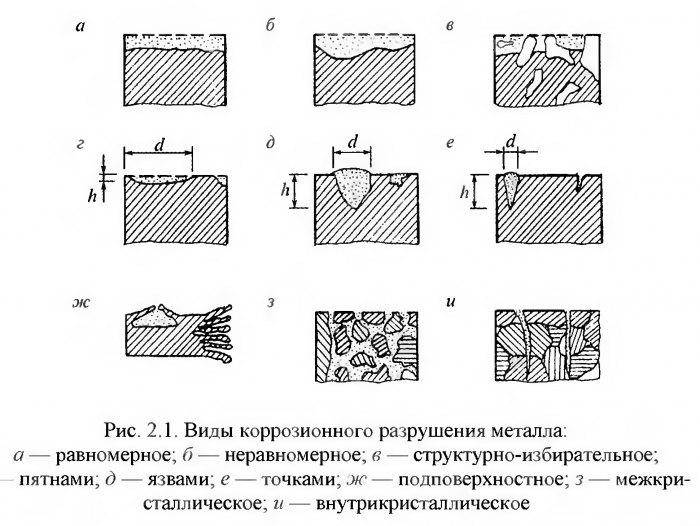
Выделяют следующие виды коррозии алюминия и его сплавов:
- Поверхностная – наиболее распространенная, приносит наименьший вред, легко заметна и быстро поддается устранению.
- Локальная – разрушения наблюдаются в виде углублений и пятен. Опасный вид коррозии в силу своей незаметности. Встречается в труднодоступных частях и узлах металлических конструкций.
- Нитеподобная, филигрань – наблюдается под покрытиями из органики, на ослабленных местах поверхности.

Это сокращает срок эксплуатации изделий. В гальванической паре алюминий может корродировать, при этом он защищает другой металл.
Защитные краски по металлу
По температурному режиму эксплуатации краски делятся на две большие группы:
- обычные, используемые при температурах до 80 °С;
- термостойкие.
По типу связующей основы краски бывают:
- алкидные;
- акриловые;
- эпоксидные.
Лакокрасочные покрытия по металлу имеют следующие достоинства:
- качественная защита поверхности от коррозии;
- легкость нанесения;
- быстрота высыхания;
- много разных цветов;
- долгий срок службы.
Большой популярностью пользуются молотковые эмали, не только защищающие метал, но и создающие эстетичный внешний вид. Для обработки металла распространена также краска-серебрянка. В ее состав добавлена алюминиевая пудра. Защита металла происходит за счет образования тонкой пленки окиси алюминия.

Краска-серебрянка
Эпоксидные смеси из двух компонентов отличаются исключительной прочностью покрытия и применяются для узлов, подверженных высоким нагрузкам.
Коррозия алюминия в щелочах
Щелочи легко растворяют защитную оксидную пленку на поверхности алюминия, он начинает реагировать с водой, в результате чего металл растворяется с выделением водорода (коррозия алюминия с водородной деполяризацией).
Также оксидную пленку разрушают соли ртути, меди и ионы хлора.
Алюминий – широко распространенный в промышленности и быту металл. Окисление алюминия на воздухе не происходит. Его инертность обусловлена тонкой оксидной пленкой, защищающей его. Однако под влиянием определенных факторов из окружающей среды этот метал все же подвергается разрушительным процессам, и коррозия алюминия – не такое уж и редкое явление.
Алюминий в морской воде
Хлориды в морской воде
Обычно морская вода содержит около 35 г/л растворенных неорганических солей, из которых хлориды составляют около 19 %. С этим связана повышенная коррозионная активность морской воды.
Величина pH морской воды
Величина pH морской воды вблизи поверхности морей и океанов является очень стабильной и составляет около 8,2. Эта величина pH находится внутри интервала стабильности естественной оксидной пленки. Это объясняет хорошую стойкость к коррозии алюминия в морской воде.
Алюминиевые сплавы для морской воды
В морской воде особенно высокую долговечность проявляют алюминиево-магниевые сплавы (AlMg) с содержанием магния не более 2,5 %. Из этих сплавов изготавливают корпуса судов и другие несущие конструкции. Для палубных надстроек вполне хватает коррозионной стойкости алюминиевых сплавов серии 6ххх (сплавы AlMgSi).
7 СНиП 2.03.11-85 – основные положения правил
Мы хотим очень кратко рассмотреть данные СНиП, описывающие требования к защите от ржавчины строительных (алюминиевых, металлических, стальных, железобетонных и иных) конструкций. В них даются рекомендации по использованию разных методов антикоррозионной защиты.

СНиП 2.03.11 предусматривают защиту поверхностей строительных конструкций следующими способами:
- пропиткой (уплотняющего типа) материалами с повышенной химической стойкостью;
- оклейкой пленочными материалами;
- применением разнообразных лакокрасочных, мастичных, оксидных, металлизированных покрытий.

Защита от огня
Алюминий и его сплавы с магнием в компактной форме, в частности в виде строительных профилей, ни в твердом, ни в расплавленном состоянии не горят, не поддерживают горения и не способствуют распространению пламени. Это обусловлено наличием на алюминии поверхностной окисной пленки, которая огнеупорна, и тем, что ввиду высокой теплопроводности алюминия теплота с поверхности быстро “оттягивается” в толщу металла.
Примечание. Все более частой причиной пожаров в настоящее время становятся намеренные поджоги с предварительным выводом из строя извещателей пожарной сигнализации и систем активного автоматического пожаротушения. Поэтому все более значимую роль начинают играть средства пассивной защиты.
Однако это же “оттягивание” теплоты приводит к быстрому нагреванию алюминиевых конструкций до температуры 200 – 250 градусов Цельсия, при которой они начинают терять прочность, что может привести к катастрофическим последствиям.
Одним из средств пассивной защиты от огня является окрашивание опорных конструкций здания, ограждений интумесцентными ЛКМ. Эти материалы образуют лакокрасочные ПК, которые способны вспучиваться под воздействием высоких температур или при контакте с пламенем и увеличиваться в объеме в десятки раз, создавая негорючую пену с низкой теплопроводностью, что препятствует слишком быстрому нагреванию подложки. Пена (другое название – пенококс), которая образуется при этом, должна быть не только негорючей и иметь низкую теплопроводность, но и удерживаться на подложке в течение заданного времени. В России ЛКМ, удовлетворяющие данным требованиям, называют чаще не интумесцентными, а вспучивающимися красками (ВК), хотя ясно, что вспучивание – свойство ПК, а не краски.
Эти краски, в отличие от других средств пассивной защиты – асбестоцементных обмазок, вермикулитовых плит, не утяжеляют конструкцию. Наиболее часто используемые ныне ВК изготавливают из таких основных компонентов, как полимерный пленкообразователь, полифосфат аммония, обусловливающий вспенивание, негорючесть и прочность пены, пентаэритрит, также активно участвующий в образовании пенококса, меламин, роль которого заключена в сочетании способностей к интенсивному газовыделению и к укреплению образующегося пенококса.
В качестве компонента, обеспечивающего вспучивание при нагревании, недавно начали использовать так называемые интеркалированные соединения графита (ИСГ). Под действием огня или беспламенного теплового удара ПК, содержащие ИСГ, начинают вспучиваться уже при 120 градусах Цельсия, причем их объем увеличивается в десятки раз. Из ИСГ образуется негорючая пена с низкой теплопроводностью, высокой термической стойкостью.
Наряду с этими компонентами в рецептуры ВК могут быть введены ингибиторы, поверхностно-активные вещества, наполнители, пигменты, другие функциональные добавки.
Интумесцентные ЛКМ можно считать выдающимся достижением науки и техники в деле борьбы с пожарами, а традиционные ЛКМ, образующие лишь негорючие покрытия, следует считать “уходящими со сцены”, поскольку они не защищают конструкцию от нагревания до критической температуры.
Примером такой ВК может быть “Файрекс-200”, образующий ПК, вспучивание которого начинается при температуре 120 градусов Цельсия. Несколько ВК разработано для защиты от пожара алюминиевых конструкций в самолетах. ПК из них начинают вспучиваться при температуре 180 градусов Цельсия.
В.А.Войтович
Доцент
Нижегородского архитектурно-
строительного университета
Как почистить алюминий от окисления

Алюминий – легкий, прочный металл, который быстро и равномерно нагревается. Эти качества делают его пригодным для изготовления кухонной утвари, в первую очередь кастрюль и сковородок, дуршлагов.
Однако первоначально блестящие или ровно-матовые предметы домашнего обихода из алюминия теряют свой привлекательный внешний вид, покрываясь окисью, пятнами, трудносмываемым налетом или подгорают до черноты.
Такую посуду неприятно и даже опасно использовать для приготовления пищи. Поэтому рекомендуется разобраться, как почистить утварь из алюминия, избавить ее от нагара и окиси.
Способы очистки алюминия от пятен, окиси
Вариант 1. Кислая жидкость. Налёт, темные пятна можно убрать, налив на дно посуды кефир или прокисшее молоко, огуречный рассол, кока-колу и оставив его на 10-12 часов.
Бока кастрюли можно обмотать ветошью, пропитанной соответствующим составом, и несколько раз смачивать им же, не допуская пересыхания. После замачивания утварь промывают под струей прохладной воды и оттирают загрязнения мягкой тряпочкой.
Вариант 2. Кислые яблоки. Нарезанными на ломтики яблоками протирают поверхность алюминиевой посуды, если она потемнела со временем. Подождав около часа, можно повторить процедуру. Затем посуду промывают и оттирают тряпкой или мягкой губкой.
Для приготовления раствора используется теплая вода и соль в пропорции 1:1, важно дождаться полного растворения. После замачивания губкой очищают поверхность до блеска, затем промывают прохладной водой
Вариант 4. Винный камень. Это классический способ, к которому прибегали с тех времен, когда алюминиевая посуда только начала входить в повседневный обиход. Винный камень образуется на дне емкостей, в которых долгое время хранится вино.
Этот осадок собирают и растворяют в горячей воде. После того как раствор остынет, в нем хорошо смачивают мягкую ветошь или салфетку, после чего обрабатывают предмет из алюминия со следами потемнения и окиси.
Чтобы натереть посуду до зеркального блеска, из винного камня и воды готовят густую кашицу. Полировка займет немало времени и потребует определенных усилий.
Затем утварь моют в прохладной воде и протирают насухо мягкой тканью. Чистка винным камнем считается более щадящей по сравнению с использованием лимонной кислоты или уксуса, воздействием высоких температур при кипячении.
Вариант 5. Сода. Натрий двууглекислый насыпают в небольшую пиалу или другую подходящую емкость, добавляют немного воды до образования кашицы. Полученный состав наносят на потемневшую поверхность кастрюли и растирают мягкой тряпочкой. После полировки посуду хорошо промойте.
Вариант 6. Мыльный раствор + полировка. Стружку хозяйственного мыла растворяют в горячей воде, в ней же замачивают утварь. Затем промывают и обрабатывают до блеска губкой, используя смесь аммиака (5 грамм) и буры (15 грамм).
Заключение
Зная, как очистить сковороду или кастрюлю из алюминия, можно легко разобраться, чем почистить другие изделия из этого металла, которые имеются в хозяйстве, к примеру, молдинги на кухонной мебели.
Но важно знать, что выбор чистящих средств для анодированного алюминия, который отличается привлекательным желто-золотистым цветом, ограничен – можно применять только хозяйственное мыло и смесь аммиака с бурой для полировки