Способы защиты металлов от химической коррозии
Полностью предотвратить разрушение металлов в результате химического взаимодействия с агрессивными веществами, присутствующими в окружающей среде, невозможно. Однако этот процесс можно значительно замедлить. Для решения данной задачи используются следующие способы:
- уменьшение агрессии окружающей среды;
- повышение коррозиеустойчивости металла;
- исключение контакта между металлом и агрессивными веществами из окружающей среды.
Чтобы повысить коррозиеустойчивость стали, в нее включают легирующие добавки. Для покрытия металлов в целях противокоррозийной защиты используются другие металлы или неметаллические составы. Например, железо защищается от коррозии путем нанесения на его поверхность алюминия, цинка или никеля. Покрытия из
неметаллических составов выполняются при помощи разнообразных красок, лаков и полимеров, которые формируют на поверхности металлов защитную пленку, предотвращающую их контакт с окружающей средой. Преимущество использования красок и лаков заключается в наличии возможности наносить их на месте установки металлических конструкций. Кроме того, этот способ не требует больших затрат времени и денег и может применяться неоднократно по мере необходимости.

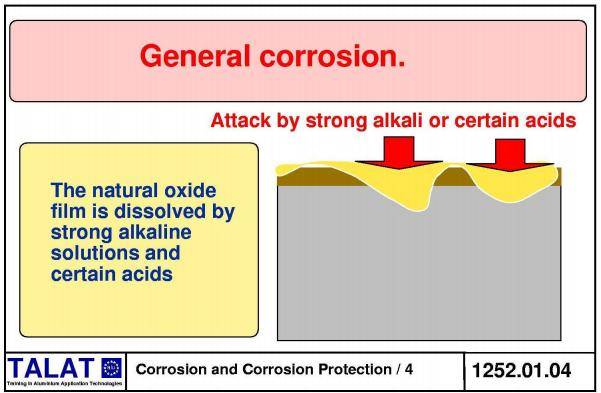
Атмосферная коррозия алюминия
Рисунок 1.1 – Атмосферная (общая) коррозия алюминия
Факторы атмосферной коррозии
Сопротивление алюминия и его сплавов атмосферной коррозии зависит:
1) от климатических условий, в которых они находятся:
- влажности;
- продолжительности и интенсивности дождей;
- температуры;
- количества солнечных дней в году;
2) от степени загрязнения воздуха, то есть концентрации:
- диоксида серы (SO2);
- оксидов азота (NOx);
- количества и химического состава пыли.
Климатические факторы и степень загрязненности атмосферы действуют совместно. Например, повешенная загрязненность воздуха может снижать критическую величину относительной влажности воздуха, при которой начинает развиваться коррозия. Эти факторы могут также давать противоположные результаты: дождь повышает влажность воздуха, но также смывает пыль и продукты коррозии, что может снижать скорость коррозии
Относительная влажность
Скорость атмосферной коррозии зависит от относительной влажности воздуха, а не просто от количества или интенсивности дождей в данной местности. Дождь является одним, но не единственным фактором, от которого зависит относительная влажность воздуха.
Уровень относительной влажности – это отношение между фактическим давлением водяного пара и максимальным давлением водяного пара при данной температуре. Это отношение выражается в процентах.
При нормальной комнатной температуре воздух считается:
- сухим, если относительная влажность составляет не более 30 %;
- нормальным, если относительная влажность находится в пределах от 50 до 60 %;
- влажным, если относительная влажность выше 80 %;
- насыщенным влагой, если относительная влажность около 100 %.
В пустынях и засушливых зонах уровень относительной влажности редко превышает 10-20 %, тогда как в умеренном климате он находится в основном между 40 и 60 %. Во время ливня она может достигать 90-95 %, а во время тропических дождей приближаться к 100 % .
Точка росы
Точкой росы называется температура, при которой будет начинаться конденсация влаги. Для данного уровня относительной влажности это та температура, до которой нужно охладить воздух, чтобы он стал насыщенным влагой, и началось ее выпадение на ближайших поверхностях.
Длительность увлажнения и сульфатный электролит
Коррозия металлов на открытом воздухе зависит от так называемой длительности увлажнения и химического состава поверхностных электролитов. Длительностью увлажнения называется период, в течение которого на поверхности металла достаточно влаги для возникновения коррозии. Длительность увлажнения обычно определяют, как время, в течение которого относительная влажность воздуха превышает 80 % и, в тоже время, температура на поверхности металла составляет выше 0 ºС. При этих условиях на поверхности металла может возникать конденсация влаги.
Критическая относительная влажность
Атмосферная коррозия металлов, в том числе, алюминия, происходит в тонких пленках влаги, которые расположены на поверхности металла. Существует критический порог относительной влажности, ниже которого алюминий и его сплавы не подвергаются коррозии. Это происходит потому, что при недостаточной влажности не хватает влаги, чтобы создать непрерывную электролитическую пленку на поверхности металла. Для свежее обработанной поверхности алюминия в не загрязненной атмосфере этот порог составляет около 66 % (рисунок 1.2) .
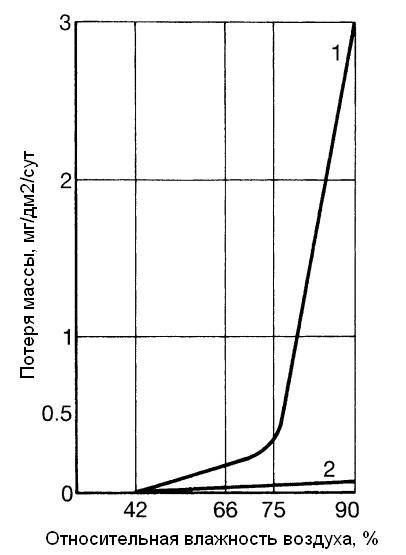 Рисунок 1.2 – Влияние влаги на атмосферную коррозию алюминия :
Рисунок 1.2 – Влияние влаги на атмосферную коррозию алюминия :
кривая 1 – с концентрацией SO2 около 1 %; кривая 2 – без SO2
Нет сульфатов – нет коррозии
В нормальных сельских районах и в атмосферах с умеренной степенью загрязненности сульфатами, стойкость алюминия к воздействию окружающей среды очень высокая. В атмосфере с высоким содержанием сульфатов и высокой влажностью на алюминиевых изделиях может возникать точечная (язвенная) коррозия. В таких условиях алюминий может потребовать коррозионной защиты.
Хлориды
Присутствие в воздухе солей (особенно хлоридов) снижает долговечность алюминия, но в меньшей степени, чем для большинства других строительных материалов. Максимальная глубина ямок коррозии составляет обычно только незначительную часть толщины алюминиевой детали. В отличие от углеродистой стали прочностные свойства алюминиевых деталей, подвергшихся коррозии, остаются практически неизменными.
Рекомендации
Советы:
- На защите деталей лучше не экономить, и покрыть их резиновой или полимерной краской.
- Перед использованием абразивов нужно попробовать удалить ржавчину щадящими составами.
- Сложные коррозионные процессы можно останавливать с помощью агрессивных химикатов, но прежде чем их использовать, нужно изучить свойства состава, характеристики металла, чтобы предотвратить возможные негативные реакции.
Коррозионные процессы могут быстро разрушить любой материал. Порча металлоконструкций в некоторых ситуациях может иметь катастрофические последствия. Изучив способы защиты от образования коррозии, нужно применить один из наиболее подходящих.
4 Что представляет собой химическая коррозия?
Под таким явлением понимают разрушение металла, вызываемое контактом коррозионной среды и материала. Причем при подобном взаимодействии наблюдается сразу два процесса:
- коррозионная среда восстанавливается;
- металл окисляется.
Электрохимическая коррозия металлов отличается от химической тем, что последняя протекает без электротока. А первопричина этих видов коррозии, коей является термодинамическая неустойчивость, остается неизменной. Металлы легко переходят в разные состояния (включая и более устойчивые), причем в этом случае отмечается снижение их термодинамического потенциала.

Существуют далее приведенные виды химкоррозии:
- в жидких составах, которые не причисляются к электролитами;
- газовая.
К жидкостям-неэлектролитам относят составы неспособные проводить электроток:
- неорганические: сера в расплавленном состоянии, жидкий бром;
- органические: бензин, керосин, хлороформ и иные.
Неэлектролиты в чистом виде с металлами не контактируют. Но при появлении в жидкостях совсем малого числа примесей сразу же “стартует” химическая коррозия металлов (причем весьма бурная). В тех ситуациях, когда реакция проходит еще и при повышенных температурах, ржавление будет происходить намного интенсивнее. А если в неэлектролитические жидкости попадает вода, запускается механизм электрохимической коррозии, описанный нами выше.

Процесс ржавления (химического) чаще всего идет в пять этапов:
- сначала к поверхности металла подходит окислитель;
- на поверхности стартует хемосорбция реагента;
- после этого начинает формироваться оксидная пленка (взаимодействие металла и окислителя);
- отмечается десорбция материала и оксидов;
- фиксируется диффузия в жидкость-неэлектролит оксидов.
Два этапа, указанные последними, отмечаются не каждый раз.
Коррозия в неэлектролитных жидкостях
Общие сведения
К жидким неэлектропроводным средам (а точнее, неэлектролитным жидкостям) можно отнести такие органические вещества, к примеру:
- Керосин.
- Бензол.
- Бензин.
- Хлороформ.
- Нефть.
- Спирты.
- Фенол.
- Тетрахлорид углерода.
Еще к таким жидкостям причисляют малое количество жидкостей неорганического типа, к примеру, жидкий бром и сера, которая расплавлена. При этом следует отметить, что растворители органического типа сами по себе не будут вступать в реакцию с металлами, но, при наличие маленького объема примесей появляется интенсивный процесс взаимодействий. Скорость коррозии увеличивают находящиеся в нефти элементов с содержанием серы.
Также, для усиления коррозийных процессов нужны высокие температуры. Влага будет интенсифицировать развитие коррозии по электромеханическому принципу. Еще одним фактором быстрого коррозийного развития – бром в жидком виде. При нормальной температуре он особенно разрушительно будет воздействовать на высокоуглеродистые стали, титан и алюминий. Менее существенно воздействие брома на никель и железо, а самую большую устойчивость к жидкому типу брома будут показывать тантал, свинец, платина и серебро.
Расплавленная сера будет вступать в агрессивные реакции практически со всеми металлами, и в первую очередь с оловом, свинцом и медью. На углеродистые марки титан и стали сера будет влиять меньше, а еще практически полностью разрушает алюминий. Защитные действия для металлических конструкций, которые находятся в неэлектропроводных средах жидкого типа, проводят добавлением устойчивым к определенной среде металлом (к примеру, сталей с большим содержанием хрома). Еще используются особые защитные покрытия (к примеру, в среде, где есть много серы, применяют алюминиевые покрытия).
Способы защиты от коррозии
Способы борьбы с коррозией будут включать в себя:
- Обработку главного металла защитным слоем (например, нанесение лакокрасочного материала).
- Применение ингибиторов (арсенитов или хроматов).
- Внедрение материалов, которые устойчивые к коррозийным процессам.
Подбор определенного материала будет зависеть от потенциальной эффективности (тут имеется виде финансовой и технологической) ее применения.
Современные принципы по защите металла от химической коррозии металла будут основаны на следующих методиках:
- Улучшение споротивляемости химического типа. Себя смогли успешно зарекомендовать устойчивые материалы (стекло, высокополимерный пластик и керамика).
- Изоляция материала от агрессивных сред.
- Уменьшение агрессивности технологической среды – в роли примеров таких действий можно выполнить нейтрализацию и удалить кислотность в коррозионой среде, а еще применять различные ингибиторы.
- Защита электрохимического типа (накладывание внешнего тока).
Указанные методики будут подразделяться на две группы:
- Повышение сопротивляемости химического типа и изолирование будет применяться до того, как металлическая конструкция запускается в использовании.
- Уменьшение агрессивности и защиты электрохимического типа применяется уже при применении изделий и металла. Использование обеих методик дает возможность внедрять новые защитные методы, и в результате защита будет обеспечиваться изменением эксплуатационных условий.
Одним из самых часто используемых методов защиты металла является антикоррозийное гальваническое покрытие, но это экономически нерентабельно при большой площади поверхности. Причина в больших тратах на процесс подготовки. Ведущее место среди методов по защите будет занимать покрытие металла лакокрасочным материалом.
И все-таки, окрашенная поверхность защищает металлы от процессов коррозии даже при локальном повреждении пленки, тогда как несовершенные покрытия гальванического типы способны даже ускорить коррозию.
Положительный эффект от коррозии
Коррозия не всегда означает только повреждения и потери. Существует также и конструктивная коррозия, когда коррозийное воздействие на металлы производится с целью:
- Подчеркнуть его микроструктуру;
- Создать морщинистую или глянцевую поверхность;
- Покрыть защитными слоями;
- Получить матричный тип;
- Выполнить селективное удаление материала;
- Выработать водород;
- Создавать художественные декорации.
Ярким примером, когда коррозия выступает не только как художественное покрытие, но и одновременно является защитным слоем, является Cor-Ten сталь, которая на сегодняшний момент широко применяется как в украшении интерьеров, так и в экстерьере, например, вентилируемые фасады из кортен стали.

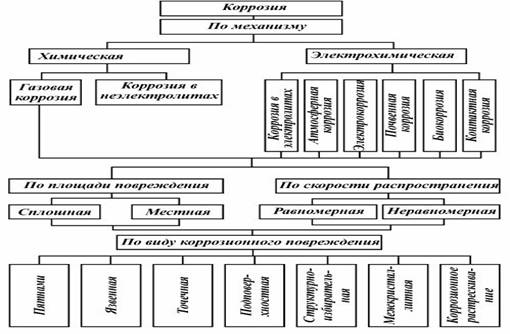
О видах коррозии
Всего существует несколько разновидностей коррозии металлических труб:
- поверхностная, распространяющаяся по всей площади трубы;
- местная, расположенная на отдельных участках;
- щелевая, образовавшаяся в небольшой трещине.
Наиболее настораживает местная коррозия, так как основная масса повреждений происходит в результате ее появления. Развитие щелевой тоже распространено, но к существенным повреждениям материала она не приводит.

Процент вероятности возникновения коррозии в большую сторону отдается участкам труб, продолженных под железнодорожными переездами или под опорами линий воздушных электропередач. Скорость развития процесса коррозии колеблется от 3 до 30 мм в год.
Что такое химическая коррозия
Этот процесс возникает в неэлектропроводных средах. Ими могут оказаться газы, нефтепродукты и спиртовые соединения. При повышении температурных показателей скорость развития коррозии возрастает. Ржавчина может образовываться на цветных или черных металлах. Алюминиевые изделия под влиянием коррозионных факторов покрываются тонкой пленкой, которая после обеспечивает систему защиты и создает препятствие развитию окислительного процесса.


Сплавы могут быть восприимчивы к иному виду ржавчины, то есть присутствуют элементы, не подверженные окислению, а напротив, они восстановленные. К примеру, при повышенных температурных характеристиках и повышенном давлении восстанавливаются карбиды, но, опять же, утрачиваются нужные качества.
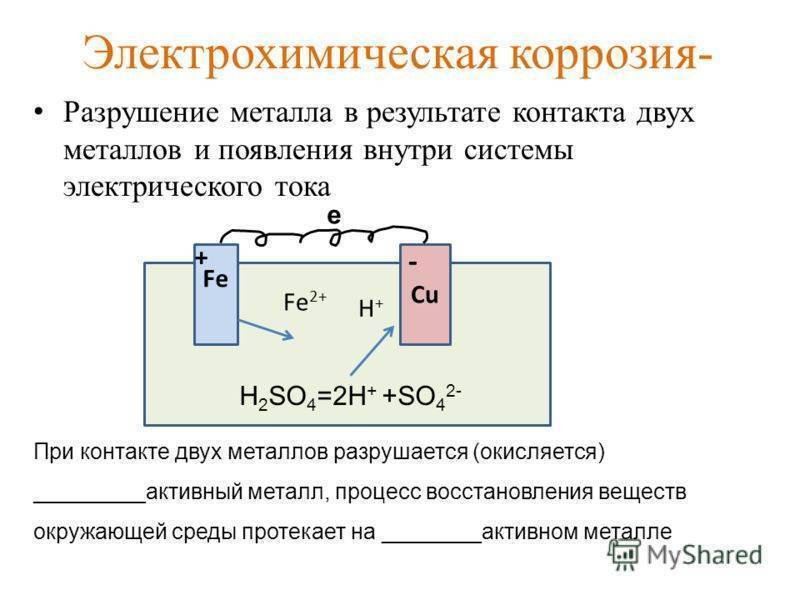
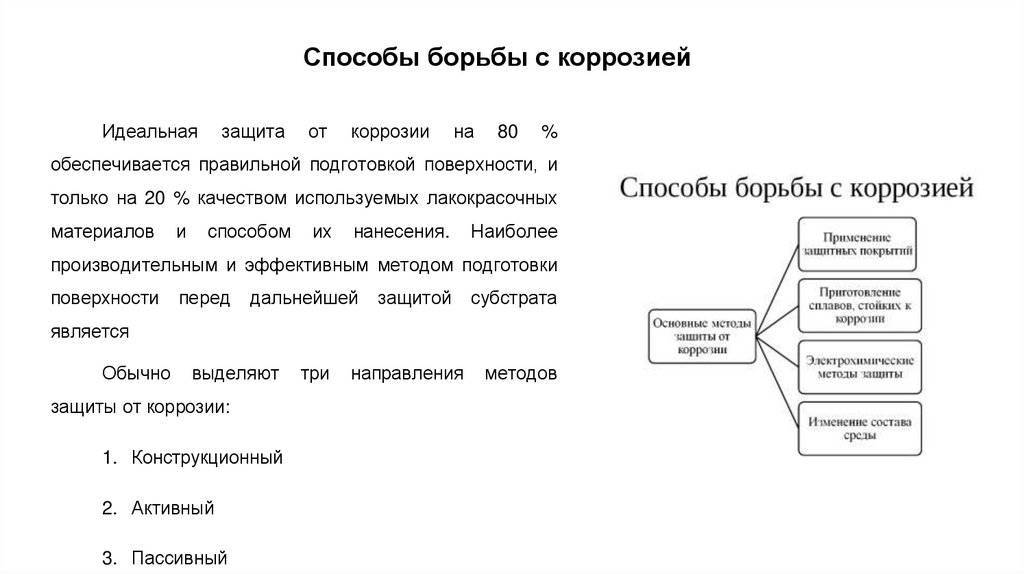
Об электрохимической коррозии
Утверждение о том, что электрохимическая коррозия достигается только при контактировании металлической поверхности с электролитом, ошибочно. Хватает тонкой пленки на основании материала, чтобы образовалась коррозия. Причиной этого вида ржавчины является использование поваренной или технической солей. К, примеру, если производится посыпка снега на дорогах, то страдают машины и проложенные под землей трубопроводы.

Процесс этого происхождения заключается в следующем:
- В соединениях металлических конструкций теряются отчасти атомы, осуществляется их переход в электролитический раствор, то есть происходит образование ионов. Замещают электроны атомы, они заряжают материал отрицательными зарядами, при этом накапливаются положительные заряды в электролите.
- Электрохимическую коррозию также вызывают блуждающие токи, которые при утечке из электроцепи уходят в растворы воды или в грунт, а после в саму структуру металла. Конкретными местами проявления ржавчины являются те участки, откуда в воду попадают блуждающие токи.
Статья по теме: Как предотвратить коррозию бетона и защитить материал от разрушения?

На видео: электрохимическая коррозия металлов и способы защиты.
Особенности катодной защиты трубопроводов
Коррозия – основная причина разгерметизации всех типов трубопроводов. Из-за повреждения металла ржавчиной на нем образуются разрывы, каверны и трещины, приводящие к разрушению стальной конструкции. Данная проблема особенно критична для подземных трубопроводов, которые постоянно пребывают в постоянном контакте с грунтовыми водами.
Катодная защита газопроводов от коррозии выполняется одним из вышеуказанных способов (посредством внешнего выпрямителя либо гальваническим методом). Технология в, данном случае, позволяет уменьшить скорость окисления и растворения металла, из которого изготовлен трубопровод, что достигается за счет смещения его естественного коррозийного потенциала в отрицательную сторону.
Посредством практический испытаний было выяснено, что потенциал катодной поляризации металлов, при котором замедляются все коррозийные процессы, равен -0.85 В, тогда как у подземных трубопроводов в естественном режиме он составляет -0.55 В.
Чтобы противокоррозионная защита было эффективной, необходимо посредством постоянного тока снизить катодный потенциал металла, из которого изготовлен трубопровод, на -0.3 В. В таком случае скорость корродирования стали не превышает 10 микрометров в течении года.
Схема катодной защиты трубопровода
Катодная защита – наиболее эффективный метод защиты подземных трубопроводов от блуждающих токов. Под понятием блуждающих токов подразумевается электрический заряд, который попадает в землю в результате работы точек заземления ЛЭП, громоотводов либо движения поездов по железнодорожным магистралям. Точное время и место появления блуждающих токов выяснить невозможно.
Коррозийное воздействие блуждающих токов на металл происходит в случае, если металлическая конструкция имеет позитивный потенциал относительно электролита( для подземных трубопроводов электролитом выступает грунт). Катодная защита же делает потенциал металла подземных трубопроводов отрицательным, что устраняет риск их окисления под воздействием блуждающих токов.
Технология применения внешнего источника тока для катодной защиты подземных трубопроводов предпочтительна. Ее преимущества – неограниченный энергоресурс, способный преодолевать удельное сопротивление грунта.
В качестве источника тока противокоррозионная защита используется воздушные линии электропередач мощностью 6 и 10 кВт, если же на территории ЛЭП отсутствуют, могут применяться мобильные генераторы, работающие на газу и дизтопливе.
Оборудование для катодной защиты
Для противокоррозионной защиты подземных трубопроводов применяется специальное оборудование – станции катодной защиты (СКЗ), состоящие из следующих узлов:
- заземление (анод);
- источник постоянного тока;
- пункт управления, контроля и измерений;
- соединительные кабели и провода.
Одна СКЗ, подключенная к электросети либо к автономному генератору, может выполнять катодную защиту сразу нескольких рядом расположенных магистралей подземных трубопроводов. Регулировка тока может выполняться вручную (посредством замены обмотки на трансформаторе) либо в автоматическом режиме (если система укомплектована тиристорами).
Среди станций катодной защиты, применяемых в отечественной промышленности, наиболее технологичной установкой считается Минерва-3000 (спроектированная инженерами из Франции по заказу Газпрома). Мощности данной СКЗ достаточно для эффективной защиты 30 км подземного трубопровода.
Схема станции катодной защиты
К преимуществам установки относится:
- повышенная мощность;
- функция восстановления после перегрузок (обновление происходит за 15 секунд);
- наличие систем цифрового регулирования для контроля за рабочими режимами;
- полная герметичность ответственных узлов;
- возможность подключения оборудования для удаленного контроля.
Также широко востребованными в отечественном строительстве являются установки АСКГ-ТМ, в сравнении с Минервой-3000 они имеют уменьшенную мощность (1-5 кВт), однако в стоковой комплектации система оборудована телеметрическим комплексом, который в автоматическом режиме контролирует работу СКЗ и имеет возможность дистанционного управления.
Станции катодной защиты Минерва-3000 и АСКГ-ТМ требуют питания от электросети мощностью 220 В. Удаленное управление оборудованием выполняется посредством встроенных GPRS модулей. СКЗ имеют достаточно больше габариты – 50*40*90 см. и вес – 50 кг. Минимальный срок службы устройств составляет 20 лет.
Коррозия железа и меди
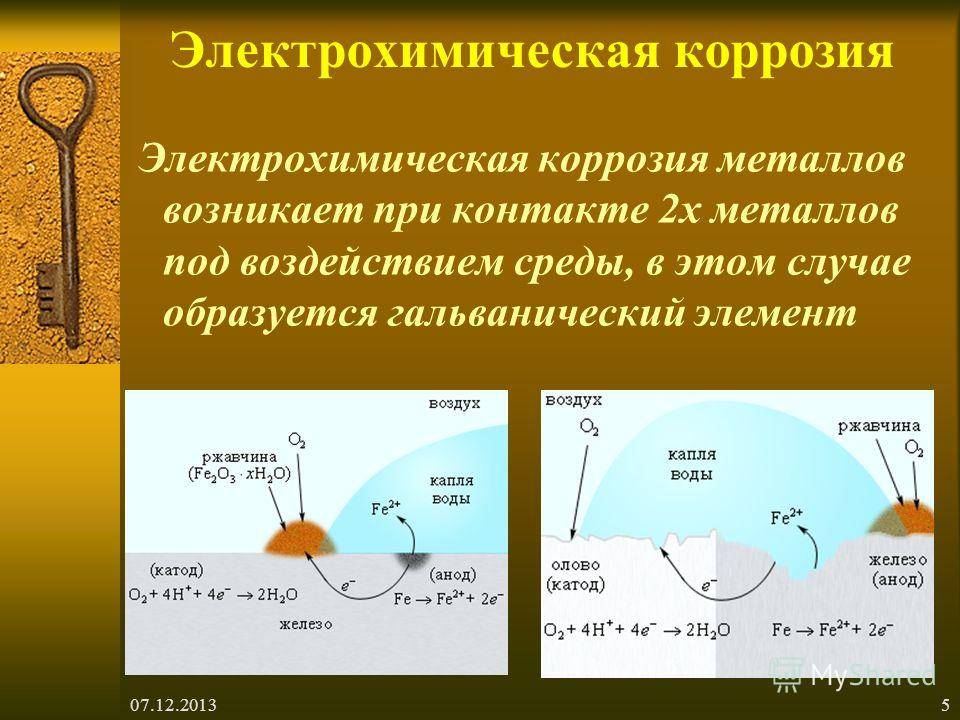
Коррозия железа
Давно выявлено, что зачастую коррозия (ржавчина) на железных элементах возникает вследствие протекания реакций окисления воздухом или кислотами – окислительно-восстановительные реакции. Как и в любом металле, ржавчина захватывает верхние слои железного изделия и возникает химическая коррозия, электрохимическая или электрическая.
Если рассмотреть каждый этот процесс в отдельности то получится, что при химическом возникновении ржавчины происходит переход электронов на окислитель, в результате образовывается оксидная пленка, а реакция выглядит так:
3Fe + 2O2 = Fe3O4 (FeO•Fe2O3)
Образовавшаяся пленка не защищает материал от дальнейшего возникновения окислительно-восстановительных реакций, она свободно пропускает воздух, что способствует образованию новой ржавчины.
При электрохимической коррозии, которая чаще всего возникает с железом в грунте, протекает реакция с образованием свободного кислорода и воды, если они остаются на железном элементе, то это вызывает новые продукты коррозии.
Fe + O2 + H2O → Fe2O3 · xH2O
Электрическая коррозия железа является самой непредсказуемой, так как возникает из-за блуждающих токов, которые могут попадать к железному элементу от линий электропередач, трамвайных путей, крупногабаритного электрооборудования и другое. Блуждающий ток запускает процесс электролиза металла, а он способствует образованию ржавых пятен.
Коррозия меди
При эксплуатации медных элементов необходимо учитывать причины коррозии, зачастую они обусловлены средой, где находится элемент. Например, в таких средах как: атмосферная, морская вода, при контакте с галогеновыми веществами и в слабых растворах солей медь коррозирует стабильно медленно.
Также медь подвергается коррозии в обычных атмосферных условиях:
2Cu+H2O+CO2+O2→ CuCO3*Cu(OH)2

Механический способ удаления ржавчины
Для механической очистки принято использовать абразивы. Например: с помощью железной щётки можно убрать ржавчину на поверхности кузова. Недостаток: требуется много времени и сил для очистки всего кузова автомобиля вручную. Чтобы упростить себе жизнь можно воспользоваться шлифовальной машиной. При помощи шлиф-диска нужно зачистить очаги коррозии на 6–8 мм, а после зачистить мелкозернистой шкуркой до полной гладкости.

Для очистки больших металлических объектов лучше использовать пескоструйные аппараты – на «зараженный» участок под давлением подается смесь из песка и воды, которая эффективно борется с ржавчиной. При работе необходимо контролировать давление, с которым смесь воздействует на металл, поскольку при чрезмерно сильном напоре может деформироваться кузов.
Ознакомиться с технологией удаления ржавчины с поверхности кузова можно на видео:
Коррозия металлов. Способы борьбы с коррозией
Как организовать дистанционное обучение во время карантина?
Помогает проект «Инфоурок»
Описание презентации по отдельным слайдам:
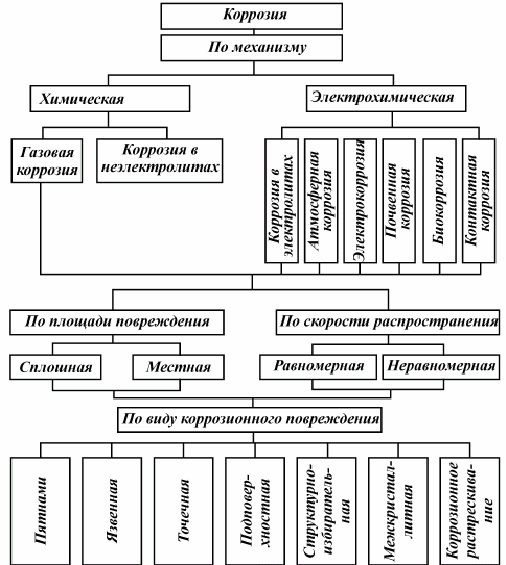
Определение: Коррозией (от латинского corrodere – разъедать) называют самопроизвольное разрушение металлов и сплавов под влиянием окружающей среды.
Коррозия вызывает серьезные экологические последствия. Утечка газа, нефти и других опасных химических продуктов из разрушенных коррозией трубопроводов приводит к загрязнению окружающей среды.
Коррозию металлов и сплавов (их окисление) вызывают такие компоненты окружающей среды, как вода, кислород, оксиды углерода и серы, содержащиеся в воздухе, водные растворы солей.
Эти компоненты непосредственно окисляют металлы – происходит химическая коррозия. При электрохимической коррозии (наиболее частая форма коррозии) всегда требуется наличие электролита (Конденсат, дождевая вода и т. д.) как, например, при ржавлении железа во влажной атмосфере.
Чаще всего коррозии подвергаются изделия из железа. Особенно корродирует металл во влажном воздухе и воде. Химическое уравнение этого процесса: 4Fe + 3O2 + 6H2O → 4FeO(OH)•H2O
Химически чистое железо почти не корродирует, а техническое железо, которое содержит различные примеси, например в чугунах и сталях, ржавеет. Следовательно, одной из причин возникновения коррозии является неоднородность металла.
Способы борьбы с коррозией: 1. Нанесение защитных покрытий на поверхности предохраняемого от коррозии металла. Для этого используют масляные краски, эмали, лаки. Эти неметаллические покрытия недорогие, но обычно недолговечные.
Способы борьбы с коррозией: Предохраняемый металл можно покрыть слоем другого металла: золота, серебра, хрома, никеля, олова, цинка и др. Один из самых старых способов – лужение – это покрытие железного листа слоем олова. Такое железо называют белой жестью.