7 СНиП 2.03.11-85 – основные положения правил
Мы хотим очень кратко рассмотреть данные СНиП, описывающие требования к защите от ржавчины строительных (алюминиевых, металлических, стальных, железобетонных и иных) конструкций. В них даются рекомендации по использованию разных методов антикоррозионной защиты.
СНиП 2.03.11 предусматривают защиту поверхностей строительных конструкций следующими способами:
- пропиткой (уплотняющего типа) материалами с повышенной химической стойкостью;
- оклейкой пленочными материалами;
- применением разнообразных лакокрасочных, мастичных, оксидных, металлизированных покрытий.
Методы антикоррозийной защиты
Антикоррозионное покрытие металла защищает от воздействия негативной атмосферы. Методы нанесения таких покрытий тоже различаются как по составу, так и по способу их нанесения.
Самым распространенным способом защиты является покраска антикоррозионными средствами. Жидкое антикоррозионное вещество наносится на поверхность, которую необходимо защитить, с помощью кисти, валика или распыляется. А после того, как краска высохнет, образуется пленка, которая плотно прилегает к изделию и защищает его от коррозии. В использовании такого метода есть некоторые минусы. Например, краска способна пропускать влагу или кислород, которые вызывают коррозию. Поэтому перед тем, как провести покраску, поверхность прежде всего грунтуют.
Антикоррозийное средство KUDO
Итак, вторым методом является грунтовка. Она также наносится на материал, как и краска. Но защищает его гораздо сильнее, так как содержит в себе мелкодисперсный порошок цинка, в который добавлен оксид цинка. Вступая во взаимодействие с железом, такое вещество защищает его от коррозии.
Другим распространенным методом защиты от ржавления металлических конструкций является нанесение металлических антикоррозийных покрытий. Такой способ представляет собой гальванизацию, плазменное напыление или сверхзвуковое, электроискровые способы покрытия. Такая защита более надежна. Она не вызывает тяжелых негативных последствий при повреждении конструкции.
Еще одним способом для защиты металлических изделий от влаги и кислорода является керамическое покрытие. Но этот метод применяется только при изготовлении высокотемпературных конструкций. Потому что он требует сильного нагрева для создании высокого уровня адгезии керамики к изделию.
Антикоррозийное керамическое покрытие на автомобиле
Виды коррозии
За всё время работы с металлическими изделиями, люди выделили несколько видов коррозии металла:
- Почвенная — тип коррозии, которая поражает конструкции, находящиеся в земле. Из-за особенного состава грунта, наличия грунтовых вод, происходят химические процессы, вызывающие появление ржавчины.
- Атмосферная — процесс окисления, протекающий в ходе контакта водяных паров воздуха с металлической поверхностью. Чем больше вредных веществ в воздухе, тем быстрее появиться коррозия.
- Жидкостная — такому виду коррозии подвержены металлоконструкции, находящиеся в воде. Если в жидкости содержится соль, процесс разрушения материала будет протекать быстрее.
Выбор антикоррозийного состава зависит от того, в какой среде будет эксплуатироваться металлическая деталь.
Свойства меди
Медь — это переходный элемент с ярко выраженными пластическими свойствами. Имеет золотистый цвет, а при отсутствии оксидной пленки — с добавлением розового. Это первый металл, который начал использовать человек. Латинское наименование элемента Cuprum (древн. Aes cuprium, Aes cyprium) произошло от названия острова Кипр, где в древности медь добывалась. Второе название — Aes, в переводе с латыни означает «руда» или «рудник».

- На воздухе металл покрывается оксидной пленкой, которая придает ему отличительный красно-желтый цвет. Медь вместе с золотом, осмием и цезием имеет преимущественно яркую окраску, что отличает их от других металлов, имеющих серебристый или серый цвет. Этот металл имеет высокую теплопроводность, а по электропроводности уступает только серебру.
- Медь характеризуется высокими коррозионными качествами и не реагирует с водой и разбавленной соляной кислотой. Окисляется «царской водкой», галогенами, кислородом. На воздухе с повышенным содержанием влаги металл окисляется и образует карбонат меди, который составляет верхний слой патины. Процесс образования защитной оксидной пленки на открытом воздухе длителен и может продолжаться несколько лет. В результате этого поверхность металла темнеет и приобретает коричневатый оттенок. После образования пленки на металле появляются соли меди, имеющие зеленоватую окраску. Оксид меди и соли называется патиной. Цвет ее изменяется от коричневатого до зеленого и черного и зависит от многих внешних факторов. Патина нейтральна к меди и наделена защитными и декоративными свойствами.
- Имея низкое удельное сопротивление, этот металл широко используется в электротехнике. Из него делают проволоку, идущую на изготовление обмоток электродвигателей. Листовой материал идет на изготовление различных элементов электрических аппаратов. Наличие в составе металла даже небольшого количества примесей значительно снижает его электропроводность.
- Медь используется для производства сплавов. На ее основе изготовляются латунь, бронза, дюралюминий и др. Благодаря высоким антикоррозионным характеристикам они широко используются для плакировки металлов с целью уменьшения коррозионного износа.
Защита металла в земле от коррозии

Металлы используются человеком с доисторических времен, изделия из них широко распространены в нашей жизни. Самым распространенным металлом является железо и его сплавы. К сожалению, они подвержены коррозии, или ржавлению — разрушению в результате окисления. Своевременная защита от коррозии позволяет продлить срок службы металлических изделий и конструкций.
Защита от коррозии
Почвенная коррозия
Почвенная коррозия – разрушение металла в почве. Ежегодные потери металла вследствии протекания почвенной коррозии достигают 4%.
Почвенной коррозии подвергаются различного назначения трубопроводы, резервуары, сваи, опоры, кабеля, обсадные трубы скважин, всякого рода металлоконструкции, эксплуатируемые в почве.
Почва – очень агрессивная среда. Она состоит из множества химических соединений и элементов, многие из них только ускоряют коррозионный процесс. Агрессивность почвы (грунта) зависит от некоторых факторов: влажность, аэрация, пористость, рН, наличие растворенных солей, электропроводность.
Классификация грунтов по коррозионной активности:
— высококоррозионные грунты (тяжелые глинистые, которые длительное время удерживают влагу);
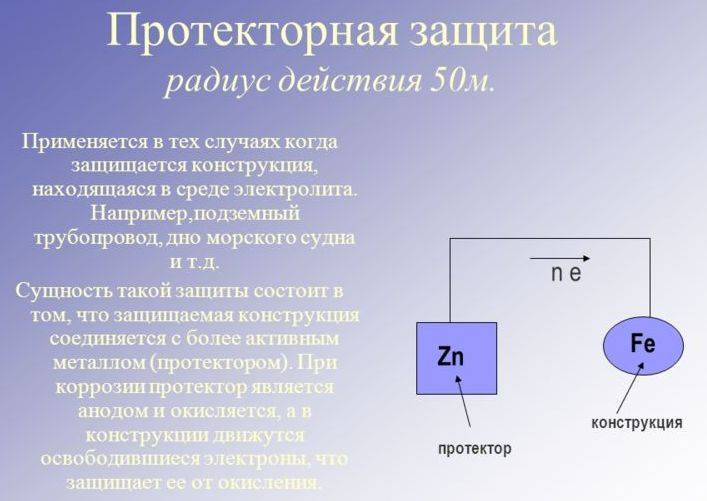
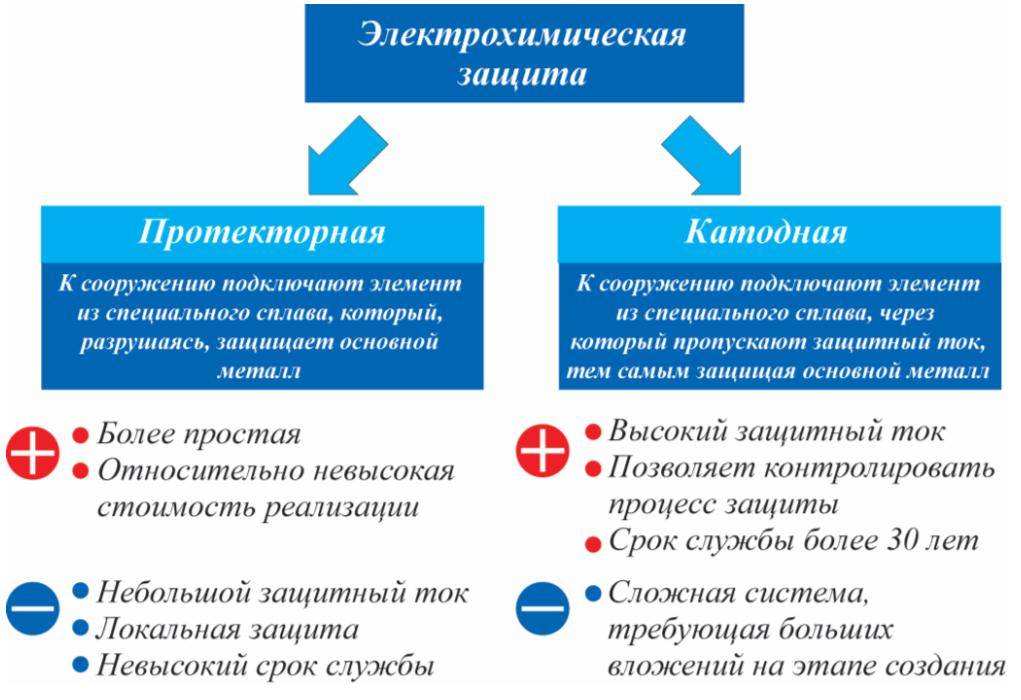
Протекторная катодная защита
Протекторная катодная защита осуществляется методом электрического контакта изделия с металлом, имеющим более отрицательную величину потенциала.
| Коррозионная диаграмма, объясняющая действие электрохимической защиты. |
Протекторная и катодная защита представляют случаи трехэлектродных систем.
Протекторная и катодная защита основана в наложении отрицательного потенциала на поверхность металла, при котором значительно замедляется процесс его ионизации.
Протекторная и катодная защита внутренней поверхности оборудования от коррозии также является перспективной. Большие технические трудности осуществления защиты сдерживают широкое применение этого способа. Принципиально схема протекторной защиты заключается в следующем: создается контакт стальной поверхности трубы с металлом, имеющим более электроотрицательный потенциал: магнием, цинком. В искусственном гальваническом элементе в присутствии электролита – воды, насыщенной H2S и С02, анод ( магний, цинк и др.) разрушается, на катоде же стальное оборудование – материальный эффект коррозии не проявляется.
Протекторную и катодную защиту применяют не только для приостановления обнаруженной коррозии, но и с целью предупреждения ее на ранее проложенных и вновь укладываемых газопроводах.
| Принципиальные схемы протекторной ( I и катодной ( / / защиты. |
Общие закономерности протекторной и катодной защиты можно установить, исходя из современной теории многоэлектродных, систем, так как эта теория позволяет разбирать случаи сложных электрохимических систем, включающих и омические содрогав.
Рассмотрим отдельно порядок проектирования протекторной и катодной защиты.
Как было показано выше, эффективность протекторной и катодной защиты во многом зависит от входного сопротивления подземного сооружения. Это сопротивление для заземленных подземных металлических сооружений получается весьма малым. Так, входное сопротивление оболочки силового кабеля, заземленного во многих участках, не превышает 0 3 Ома и поэтому СКЗ кабельной линии работает в режиме близком к режиму короткого замыкания.
Одним из эффективных противокоррозионных мероприятий является применение протекторной и катодной защиты. Поскольку в гальванической паре разрушению от электрохимической коррозии подвергается анод, при проектировании оборудования предусматриваются детали, которые заранее приносятся в жертву коррозии, в то время как срок службы основного сооружения повышается. Такими легко сменяемыми деталями являются протекторы, изготавливаемые из сплавов ( цинка, алюминия, магния), анодных по отношению к стали. Протекторная защита проста в эксплуатации и не требует постоянного обслуживания.
Для борьбы с морской коррозией широко используют протекторную и катодную защиту ( см. гл.
Для определения полноты защиты подземного сооружения при протекторной и катодной защите иногда пользуются предварительно взвешенными контрольными пластинами, устанавливаемыми в почве вблизи сооружения ( ряс. Контрольные пластины изготовляются небольших paiSMepos из того же материала, что и ващищаемая конструкция.
Известны дна способа электрохимической защиты металла от коррозии: протекторная и катодная защита внешним током ( электрозащита), По первому способ защита металла производится путем присоединения к нему другого металла с более отрицательным потенциалом. При этом защищаемый металл становится катодом, а присоединяемый – анодом, или так называемым протектором. По второму способу защита осуществляется с помощью тока от внешнего источника. В этом случае защищаемый металл присоединяется к отрицательному полюсу в качестве катода. Анодом может быть электрод из любого проводника, обеспечивающего низкое переходное сопротивление при погружении его I.
Для МНГС, размещенных на глубинах моря до 40 м, рекомендуют протекторную и катодную защиту, а для глубоководных стационарных платформ – только катодную.
Профилактика появления ржавчины
Основным этапом в борьбе с коррозионными разрушениями считается профилактика. Самым простым и действенным способом предотвращения появления ржавых пятен считается окрашивание металлических предметов и поверхностей, которое не только обновит внешний вид Вашего интерьера, но и создаст дополнительную защиту от воздействия влаги и кислорода. Рекомендации по окрашиванию конструкций в защитных целях:
прежде чем начать покраску, нужно очистить старый слой шпателем и отшлифовать пораженные ржавчиной участки шлифовальной машиной или наждачкой;
проведите обработку поверхности обезжиривающим средством;
нанесите на металл антикоррозионную грунтовку для соответствующего типа металлических конструкций;
проводите стойкое окрашивание металлических поверхностей в ясную погоду, чтобы влага не попала под краситель;
можно применять как масляные, так и эмалевые красители, но обратите внимание на их свойства и устойчивость к высоким температурам;
ровную поверхность будет удобнее обрабатывать мягким валиком, а в труднодоступных – местах длинной кистью.
В качестве альтернативы можно использовать грунт-эмаль, которая может предотвратить образование ржавых пятен и обеспечит защиту конструкции.
Решение задач по химии на покрытие металлов
Задание 284.
Если пластинку из чистого цинка опустить в разбавленную кислоту, то начавшееся выделение водорода вскоре почти прекращается. Однако при прикосновении к цинку медной палочкой на последней начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнения протекающей химической реакции.Решение:
При опускании пластинки из чистого цинка в раствор разбавленной кислоты, начавшееся выделение водорода вскоре почти прекратится, потому что на пластинке из цинка образуется оксидная плёнка, которая будет препятствовать дальнейшему взаимодействию цинка с разбавленной кислотой. Оксидная плёнка образуется при взаимодействии цинка с кислородом, растворённым в воде по схеме:
Zn + 1/2 O2 = ZnO
Если прикоснуться к цинковой пластинке медной палочкой, то возникнет гальваническая пара цинк — медь, в которой цинк будет являться анодом, а медь – катодом. Это происходит, потому что стандартный электродный потенциал цинка (-0,763 В) значительно отрицательнее, чем потенциал меди (+0,34 В).
Образующиеся ионы Zn2+ будут с имеющимися анионами кислоты давать соль, а ионы водорода Н+, деполяризуясь на медной палочке, Zn – 2 = Zn2+образуют водород, который в виде пузырьков газа выделяется из раствора. Ионно-молекулярное уравнение реакции будет иметь вид:
Молекулярная форма уравнения реакции:
Задание 285.
В чем сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов.Решение:
Для предотвращения коррозии стальных конструкций применяется протекторная защита: создаётся электрический контакт защищаемой конструкции с протектором – более активным металлом (обычно Zn, Mg, Al или их сплавы). При таком контакте возникает гальваническая пара типа Zn — Fe и коррозии подвергается протектор, а не сама стальная конструкция (трубопровод, корпус корабля и т.п.). Например, корпус корабля защищают протектором – цинковые брусья, которые крепят в нескольких местах днища корабля. Под действием морской воды и кислорода цинк разрушается, а корпус корабля защищается, таким образом, от коррозии. При этом протекают следующие электрохимические процессы:
Анодный процесс: Zn – 2 = Zn2+;Катодный процесс:
а) в нейтральной или щелочной среде: 1/2O2 + H2O + 2 = 2OH-;
б) в кислой среде: 1/2O2 + 2H+ + 2 = H2O
Таким образом, цинк разрушается, окисляясь до ионов Zn2+, которые с гидроксильными ионами образуют нерастворимый гидроксид Zn(OH)2 или в виде ионов Zn2+ уходит в раствор, если реакция среды кислая. Основной металл остаётся неповреждённым.
Задание 286.
Железное изделие покрыли никелем. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях?Решение:
Железо имеет более электроотрицательный стандартный электродный потенциал (-0,44 В), чем никель (-0,24 В), поэтому железо является анодом, никель – катодом.
Анодный процесс – окисление металла: Fe – 2 = Fe2+
и катодный процесс – восстановление ионов водорода (водородная деполяризация) или молекул кислорода (кислородная деполяризация). Поэтому при коррозии пары Fe — Ni с водородной деполяризацией происходит следующие процессы:
Анодный процесс: Fe – 2 = Fe2+ Катодный процесс: в кислой среде: 2Н+ + 2 = Н2
Продуктом коррозии будет газообразный водород соединение железа с кислотным остатком (соль).
При коррозии пары Fe — Ni в атмосферных условиях на катоде происходит кислородная деполяризация, а на аноде – окисление железа:
Анодный процесс: Fe – 2 = Fe2+
Катодный процесс: в нейтральной среде: 1/2O2 + H2O + 2 = 2OH-
Так как ионы Fe2+ с гидроксид-ионами ОН- образуют нерастворимый гидроксид, то продуктом коррозии будет Fe(OH)2. При контакте с кислородом воздуха Fe(OH)2 быстро окисляется до метагидроксида железа FeO(OH), приобретая характерный для него бурый цвет:
4Fe(OH)2 + О2 = 4FeO(OH) + 2Н2О
Так как никель имеет более электроположительный стандартный электродный потенциал, чем железо, то данное покрытие является катодным. При повреждении катодного покрытия (или наличия пор) возникает коррозионный элемент, в котором основной материал в поре служит анодом и растворяется, а материал покрытия – катодом, на котором выделяется водород или поглощается кислород. Следовательно, данное катодное покрытие может защищать железо от коррозии лишь при отсутствии пор и повреждений покрытия.
Зачем нужна антикоррозионная защита?
Антикоррозионная обработка считается приоритетной задачей для владельцев автомобилей, мастерских, строителей. Связано это с тем, что коррозия внешней поверхности металлических изделий разрушает детали, выводит оборудование из строя. Нарушение целостности металлоконструкций может привести к разрушению зданий. Негативное воздействие влаги и воздуха проявляются на различных деталях, механизмах, изготавливаемых из однородных металлов и сплавов.
Чтобы защитить металл от коррозии, используются химические составы. Они образуют слой, который не позволяет воздуху и влаге разрушить целостность материала.
Какой металл лучше использовать для защиты?
В разное время для защиты железа от коррозии применялись другие различные металлы: свинец, медь, алюминий, никель, хром и прочие. Защитное покрытие никелем и хромом защищало от коррозии и придавало металлам привлекательный, блестящий внешний вид. Однако, хоть защищаемые металлы и не ржавели в открытую, но имела место скрытая коррозия, которая развивалась скачками. К слову, именно так появилась нержавеющая сталь. К тому же, покрытие из этих металлов не всем доступно из-за цены.
Алюминий, также придавал металлам привлекательный вид, однако обладал не максимальной стойкостью к окружающей среде. Его до сих пор применяют во многих областях там, где коррозия не так вероятна, либо для финишного покрытия.
Олово или медь защищают от коррозии, но только в качестве катода. То есть создают барьер между защищаемым железом и окружающей средой. Но, если барьер будет нарушен вследствие механических повреждений или контакта с химикатами, то коррозия начнет развиваться с прежней скоростью.
Кадмий – достаточной стойкий к коррозии металл, но дефицитный и поэтому – не дешевый. Защита от коррозии с помощью кадмия активно применяется в микроэлектронике или там, где защиты требуется совсем немного. Например, в аккумуляторных батареях.
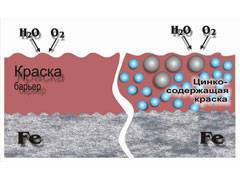
По множественным исследованиям, был выяснен металл, которой обладает отличной антикоррозийной защитой, выступает в качестве анода, то есть дает не только барьерную, но и электрохимическую защиту, к тому же обладает приемлемой ценой. Это цинк.
Именно цинковые покрытия являются самыми популярными в защите металлов от коррозии, потому, что самыми эффективными. Даже появился такой распространенный сегодня термин, как цинкование. Цинк сегодня наносится всеми вышеперечисленными способами: горячим, гальваническим, напылением, диффузионным, термомеханическим и, конечно, холодным.
Каждый из способов имеет свои плюсы и минусы.
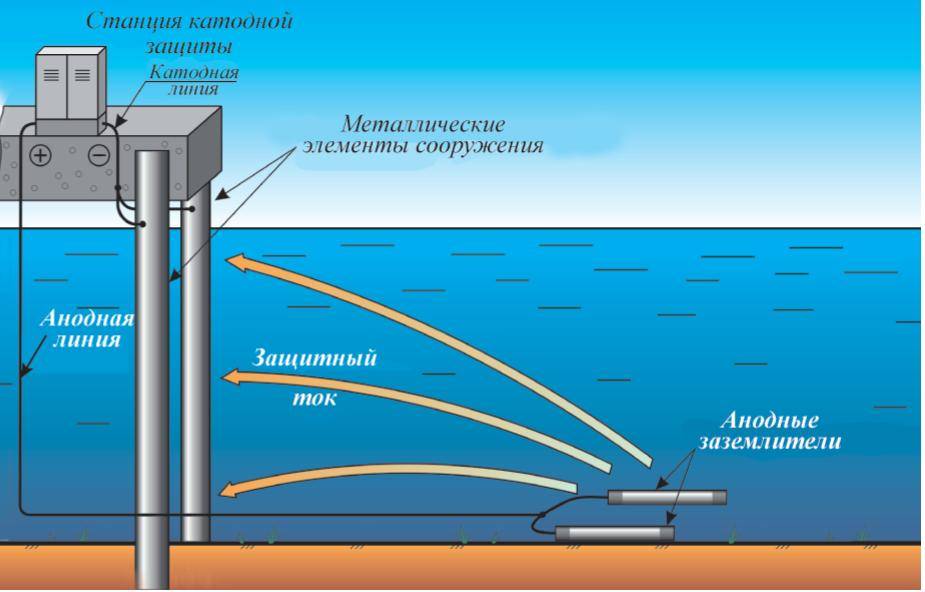
Принцип действия электрохимзащиты
Чтобы защитить газопровод от коррозии, нужно создать катодную реакцию и исключить анодную. Для этого на защищаемом трубопроводе принудительно создается отрицательный потенциал.
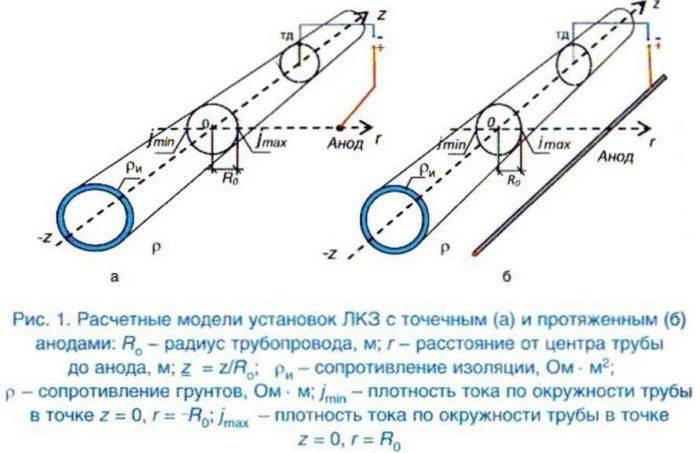
Принципы построения локальной катодной защиты
В грунте размещают анодные электроды, подключают отрицательный полюс внешнего источника тока непосредственно к катоду – защищаемому объекту. Для замыкания электрической цепи, положительный полюс источника тока соединяется с анодом – дополнительным электродом, установленным в общей среде с защищаемым трубопроводом.
Анод в данной электрической цепи выполняет функцию заземления. За счет того, что анод имеет более положительный потенциал, чем металлический объект, происходит его анодное растворение.
Процесс коррозии подавляется под воздействием отрицательно заряженного поля защищаемого объекта. При катодной защите от коррозии, процессу порчи будет подвергается непосредственно анодный электрод.
Для увеличения срока эксплуатации анодов, их изготавливают из инертных материалов, устойчивых к растворению и другим воздействиям внешних факторов.
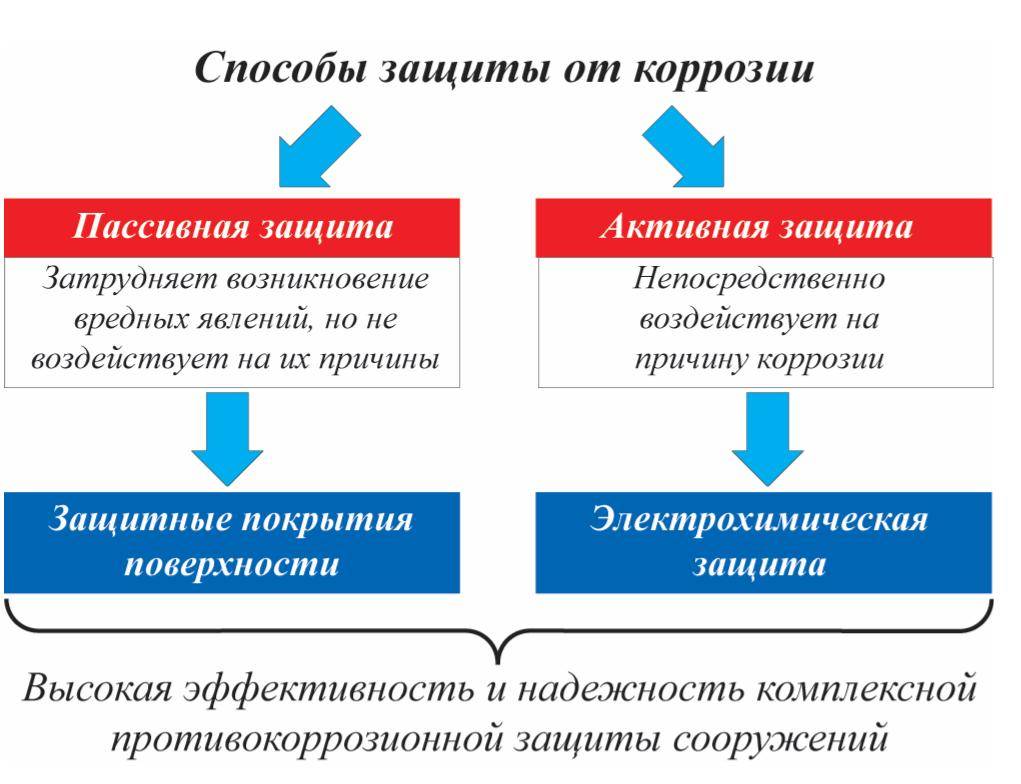
2 Защита от коррозии посредством специальных покрытий
Чтобы защитное покрытие справлялось с задачами, которые возлагаются на него, оно должно обладать целым рядом особых качеств:
- быть износостойким и максимально твердым;
- характеризоваться высоким показателем прочности сцепления с поверхностью обрабатываемого изделия (то есть обладать повышенной адгезией);
- иметь такую величину теплового расширения, которая бы незначительно отличалась от расширения защищаемой конструкции;
- быть максимально недоступным для вредных факторов окружающей среды.

Также покрытие должно наноситься на всю конструкцию как можно более равномерно и сплошным слоем.
Все используемые в наши дни защитные покрытия делят на:
- металлические и неметаллические;
- органические и неорганические.

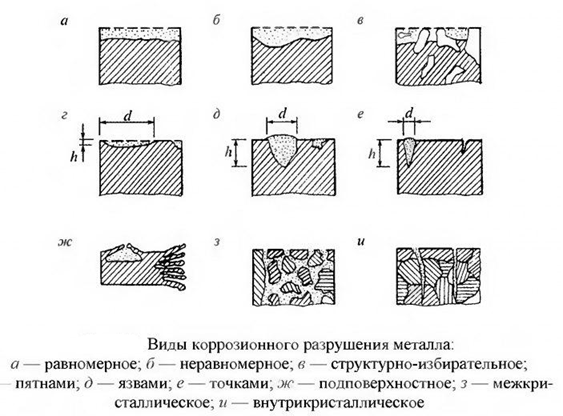
Характерные типы поражения ржавчиной
Различают следующие характерные виды поражения коррозией:
- Поверхность покрыта сплошным ржавым слоем или отдельными кусками.
- На детали возникли небольшие участки ржавчины, проникающей в толщину детали.
- В виде глубоких трещин.
- В сплаве окисляется один из компонентов.
- Глубинное проникновение по всему объему.
- Комбинированные.
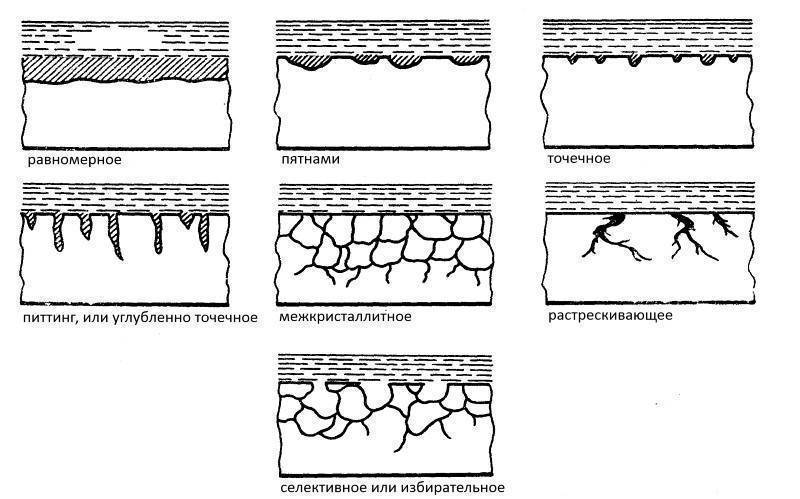
Виды коррозионных разрушений
По причине возникновения разделяют также:
- Химическую. Химические реакции с активными веществами.
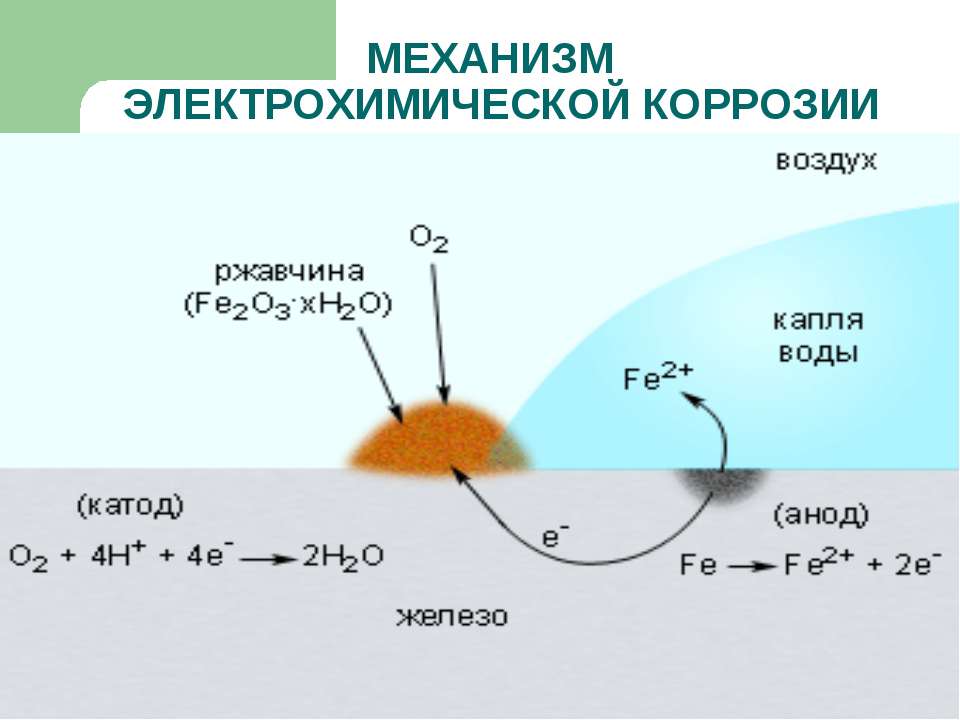
- Электрохимическую. При контакте с электролитическими растворами возникает электрический ток, под действием которого замещаются электроны металлов, и происходит разрушение кристаллической структуры с образованием ржавчины.
Коррозия металла и способы защиты от нее
Ученые и инженеры разработали множество способов защиты металлических конструкций от коррозии.
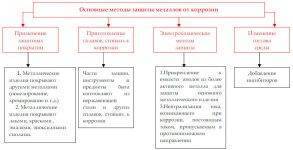
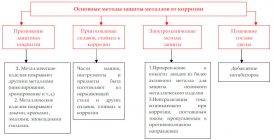
Промышленные
Промышленные методы защиты металлических изделий подразделяются на ряд направлений:
- Пассивация. При выплавке стали в ее состав добавляют легирующие присадки, такие, как Cr, Mo, Nb, Ni. Они способствуют образованию на поверхности детали прочной и химически стойкой пленки окислов, препятствующей доступу агрессивных газов и жидкостей к железу.
- Защитное металлическое покрытие. На поверхность изделия наносят тонкий слой другого металлического элемента — Zn , Al, Co и др. Этот слой защищает железо о т ржавления.
- Электрозащита. Рядом с защищаемой деталью размещают пластины из другого металлического элемента или сплава, так называемые аноды. Токи в электролите текут через эти пластины, а не через деталь. Так защищают подводные детали морского транспорта и буровых платформ.
- Ингибиторы. Специальные вещества, замедляющие или вовсе останавливающие химические реакции.
- Защитное лакокрасочное покрытие.
- Термообработка.

Порошковая покраска для защиты от коррозии
Способы защиты от коррозии, используемые в индустрии, весьма разнообразны. Выбор конкретного метода борьбы с коррозией зависит от условий эксплуатации защищаемой конструкции.
Бытовые
Бытовые методы защиты металлов от коррозии сводятся, как правило, к нанесению защитных лакокрасочных покрытий. Состав их может быть самый разнообразный, включая:
- силиконовые смолы;
- полимерные материалы;
- ингибиторы;
- мелкие металлические опилки.
Отдельной группой стоят преобразователи ржавчины — составы, которые наносят на уже затронутые коррозией конструкции. Они восстанавливают железо из окислов и предотвращают повторную коррозию. Преобразователи делятся на следующие виды:
- Грунты. Наносятся на зачищенную поверхность, обладают высокой адгезией. Содержат в своем составе ингибирующие вещества, позволяют экономить финишную краску.
- Стабилизаторы. Преобразуют оксиды железа в другие вещества.
- Преобразователи оксидов железа в соли.
- Масла и смолы, обволакивающие частички ржавчины и нейтрализующие ее.

Грунт-преобразователь ржавчины
При выборе грунта и краски лучше брать их от одного производителя. Так вы избежите проблем совместимости лакокрасочных материалов.
Виды коррозии
Ученые давно борются с коррозией и выделили несколько основных ее типов:
- Атмосферная. Происходит окисление вследствие контакта с кислородом воздуха и содержащимися в нем водяными парами. Присутствие в воздухе загрязнений в виде химически активных веществ ускоряет ржавление.
- Жидкостная. Проходит в водной среде, соли, содержащиеся в воде, особенно морской, многократно ускоряют окисление.
- Почвенная. Этому виду подвержены изделия и конструкции, находящиеся в грунте. Химический состав грунта, грунтовые воды и токи утечки создают особую среду для развития химических процессов.
Исходя из того, в какой среде будет эксплуатироваться изделие, подбираются подходящие методы защиты от коррозии.
Защитные покрытия, наносимые промышленным способом.
Защитное покрытие выполняется чаще всего в виде пленки (металлической, оксидной, лакокрасочной).
Для создания металлической защитной пленки используют метод гальванизации, нанесения металлов горячим способом или металлизации. Для этого металлическое изделие погружается в емкость с расплавленным защитным материалом (олово, свинец, цинк) с такой температурой, при которой защищаемый металл не плавится. Преимуществом метода металлизации является возможность покрыть защитным слоем уже готовые собранные изделия.
Защитное покрытие также наносят методом диффузии в основной металл другого — алюминия (алитирование или алюминирование), кремния (силицирование), хрома (хромирование), а также создания биметалла способом плакирования.
Еще один способ защиты от коррозии — оксидирование. Поскольку на металле присутствует естественная оксидная пленка, ее делают более прочной, обрабатывая окислителем (растворами кислот или их солей). Одним из видов нанесения такой пленки горячим способом является «воронение» стали.
Также горячим способом выполняется фосфатирование металла (погружение в горячий раствор кислых фосфатов железа или марганца).
Сантехнические изделия (ванны, раковины) покрываются защитным лакокрасочным слоем (эмалируются) в промышленных условиях при очень высоких температурах (до 800°С).
Для защиты металлов во время транспортировки или для хранения металлических конструкций на складах используют жидкие масла или ингибиторы.